新冠病毒究竟源自何处,谁设计、制造了新冠病毒?
本文接续:
Ralph S. Baric的病毒改造与人工合成(序篇)
Ralph
S. Baric(拉尔夫·巴里克),美国病毒学家,北卡罗来纳大学教堂山分校微生物学和免疫学院流行病学系教授;Ralph S.
Baric是国际顶级冠状病毒研究权威,反向遗传平台的发明者,无痕迹病毒改造技术的发明者,是最早人工合成冠状病毒的科学家;他还是国际顶级功能增益研究权威,病毒功能增益性改造的积极力行、狂热痴迷者。2021年4月,Ralph
S. Baric入选美国国家科学院院士。
Ralph
S. Baric(团队)与新冠病毒存在多项、多组关联关系。新冠病毒的多处特殊结构,多项特殊功能、特性,Ralph S.
Baric(团队)要么专门研究过,要么反复研究过高度相关的内容;此外,Ralph S.
Baric(团队)在不同论文中对冠状病毒的改造方向,对未来可能出现的冠状病毒的功能、特性,做过多项预测和展望,其中至少四项,在新冠病毒身上神奇地应验(、实现)了。
在Ralph S. Baric(团队)与新冠病毒的多组、多项关联关系中,存在一组双纽带关联,这组关联中的双纽带是指:
纽带一:蝙蝠冠状病毒WIV1(rs3367),自然界中已知的跨物种感染能力最强的冠状病毒。
纽带二:关键氨基酸,即冠状病毒刺突蛋白RBD(Receptor Binding Domain,受体结合域)的5个特殊位点的氨基酸,它们决定冠状病毒的刺突蛋白能否结合脊椎动物的ACE2受体,决定冠状病毒能否进入(感染)某个物种的细胞,决定冠状病毒的宿主范围。
WIV1(rs3367)、关键氨基酸与新冠病毒、与Ralph S. Baric(团队)都有非同一般的关联,它们是串连Ralph S. Baric(团队)与新冠病毒,揭示二者关系秘密的一对纽带。
相关内容将顺次通过以下六个部分展开:
I、WIV1(Rs3367)病毒
II、新冠、WIV1(rs3367)高度相似的强大跨物种感染能力、高度相似的宿主范围
III、冠状病毒刺突蛋白RBD的5个关键氨基酸
IV、新冠、WIV1(rs3367)关键氨基酸的高度关联性、高度等价性
V、Ralph S. Baric团队对WIV1(rs3367)的研究
VI、Ralph S. Baric团队对关键氨基酸的研究
为方便读者理解本文,先插贴一张冠状病毒结构示意图。
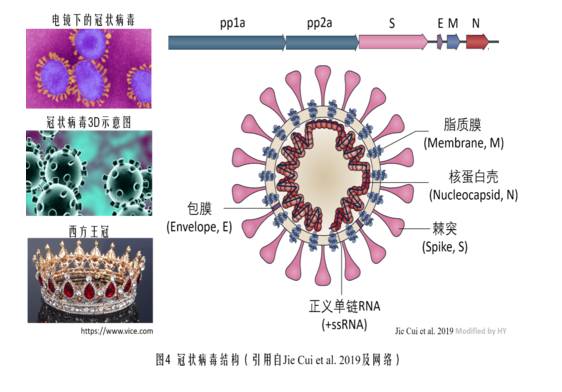
首先详细介绍一下WIV1(Rs3367)病毒。
I、 WIV1(Rs3367)病毒
rs3367、WIV1,是一对“孪生”蝙蝠冠状病毒。
rs3367,分离、分析自中华菊头蝠(又称中华马蹄蝠)的肠道与粪便样本(应该是分析出了基因序列,但没有获得有活性的病毒毒株),样本收集地点是距云南昆明约60公里的一处有多种蝙蝠混居的洞穴,收集时间是2012年3月。rs3367的全基因组序列于2013年4月8日上传到NCBI(National
Center for Biotechnology Information,美国国家生物技术信息中心)
GenBank生物信息数据库,实现了国际共享,其GenBank(ACCESSION) ID为: KC881006。
WIV1病毒也分离自中华菊头蝠(中华马蹄蝠)的肠道与粪便样本(WIV1既有基因序列,又有分离出或培养出的有活性的病毒毒株),其样本与rs3367采自同一蝙蝠洞穴,收集时间是2012年9月。2013年4月8日,WIV1的刺突蛋白(Spike蛋白,S蛋白)基因序列上传至GenBank,实现了国际共享(同一天,石正丽团队还上传了rs3367、rsSHC014的全基因组序列),其GenBank
ID为:KC881007;2013年7月8日,WIV1全基因组序列上传至GenBank,实现了国际共享,其GenBank
ID为:KF367457。在某些论文中,WIV1也称为WIV1-CoV或SL-CoV-WIV1。
为什么要一再强调基因序列的国际共享呢?因为对于病毒改造来说,最不可或缺的不是自然来源的病毒毒株,而是病毒的基因序列。有自然来源的病毒毒株当然更方便;对顶尖病毒学家来说,有没有自然来源的病毒毒株区别不是很大,因为只要有病毒的基因序列,就可以在实验室中合成该病毒的克隆毒株。
不晚于2000年,美国科学家已经掌握了使用反向遗传技术,基于病毒的基因序列,方便、快捷、精确地合成冠状病毒的cDNA、RNA,收获冠状病毒活性毒株的技术,这一技术的核心发明者就是Ralph S. Baric。
2003年10月28日,Ralph
S. Baric团队、美国陆军传染病医学研究院、范德堡大学医疗中心在PNAS(美国国家科学院院刊)联合发表了一篇论文:Reverse
genetics with a full-length infectious cDNA of severe acute respiratory
syndrome coronavirus(SARS病毒全长传染性cDNA的反向遗传学)。
https://www.pnas.org/content/100/22/12995

Ralph
S.
Baric是该论文的通讯作者。在该论文中,研究者使用他们命名的反向遗传(克隆)平台,基于SARS病毒的基因序列,先合成了SARS病毒的cDNA(complementary
DNA,互补DNA,RNA的DNA复制品),接着由cDNA转录出SARS的RNA,而后将RNA通过电穿孔释放到Vero
E6细胞(非洲绿猴肾细胞系细胞)中,最终成功收获了SARS
RNA在细胞中组装出的具有生物活性(感染、复制能力)的SARS病毒克隆毒株。也就是说,Ralph S.
Baric等人在SARS疫情发生的次年,就人工合成了SARS病毒的cDNA、RNA并收获了SARS病毒的活性毒株克隆。
SARS病毒不是Ralph
S. Baric人工合成的首个冠状病毒。2000年11月,Ralph S. Baric等人在Journal of
Virology发表了一篇论文:Strategy for Systematic Assembly of Large RNA and DNA
Genomes: Transmissible Gastroenteritis Virus
Model(大RNA和DNA基因组系统组装策略:传染性胃肠炎病毒模型)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC110934/
注:冠状病毒基因组是自然界中最大、最长的单链正极性RNA基因组,人工合成冠状病毒具有不同寻常的意义。

Ralph S. Baric仍是论文的通讯作者,该论文使用反向遗传技术,基于病毒的基因序列,人工合成了猪传染性胃肠炎病毒TGEV(Transmissible gastroenteritis virus)的cDNA并收获了其活性毒株,这是Ralph S. Baric人工合成的首个冠状病毒,也是人类首次人工合成冠状病毒。论文还明确指出:构建TGEV的方法允许对冠状病毒基因组进行精确的基因改造。
二年后的2002年11月,Ralph
S. Baric等人又在Journal of Virology发表了另一篇论文:Systematic Assembly of a
Full-Length Infectious cDNA of Mouse Hepatitis Virus Strain
A59(小鼠肝炎病毒A59毒株全长传染性cDNA的系统组装)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC136593/
在该论文中,Ralph S. Baric等人再次使用反向遗传技术,基于病毒的基因序列,人工合成了小鼠肝炎病毒MHV-A59的cDNA并收获了其活性毒株。Ralph S. Baric依然是论文的通讯作者。
经常有人说,Ralph
S.
Baric(团队)没有蝙蝠冠状病毒的毒株,不可能基于蝙蝠冠状病毒进行病毒改造,不可能将蝙蝠冠状病毒改造为新冠病毒;武汉病毒研究所是多种蝙蝠冠状病毒的发现者和毒株唯一拥有者,因此,将蝙蝠冠状病毒改造为新冠病毒的,肯定是武汉病毒研究所。
上述说法犯了三个错误。
第一,石正丽团队从未发表过任何功能增益研究论文,从未对病毒进行过任何功能增益性改造,集多种跨科属病毒功能于一身的新冠病毒,一定是功能增益研究经验异常丰富的团队设计、制造的,不可能出自功能增益研究经验为0的石正丽团队之手。
第二,石正丽团队发现、分离的蝙蝠冠状病毒毒株或病毒样本,不只收藏于武汉病毒研究所病毒库,它们还要提供给直接合作者(PREDICT项目)、直接资助者--达萨克为主席(首席执行官)的生态健康联盟。达萨克为谁工作?为美国政府工作,生态健康联盟背后的老板、金主是美国国际开发署(USAID)和美国国立卫生研究院(NIH),将病毒毒株或病毒样本提供给生态健康联盟,就是将它们提供给美国。
第三,自2000年使用反向遗传技术合成TGEV病毒后,特别是2003年反向遗传平台已臻完善后,Ralph
S.
Baric团队就不再依赖得自自然界的冠状病毒毒株了,他们可以基于病毒基因序列,使用反向遗传平台自行合成所需病毒毒株的克隆,使用人工合成的病毒毒株进行病毒研究、病毒改造。
反向遗传平台不只是可以用来合成已有病毒的毒株克隆;对病毒的基因序列进行设计、改造后,使用反向遗传平台,基于改造后的基因序列,同样可以合成出新病毒的病毒毒株。反向遗传平台实际上提供了一种精确的无痕迹病毒改造技术。
2004年后,Ralph S. Baric(团队)在研究中使用的病毒,几乎都是使用反向遗传平台人工合成的;Ralph S. Baric(团队)在“无数篇”论文中,“无数次”地使用反向遗传平台,合成已有病毒毒株,或合成改造病毒的毒株。我以前的文章已经介绍过一些实例,本系列后续文章将展示更多的实例。
石正丽团队能不能使用反向遗传技术人工合成冠状病毒?能。石正丽团队是什么时候掌握这一技术的?在2016年6月24日发表的一篇Journal
of
Virology论文中(署名作者包括达萨克),石正丽团队宣布研发出了自己的反向遗传系统,并首次应用该系统合成了三种病毒,其中之一是论文的研究对象WIV1。该论文标题为:Bat
Severe Acute Respiratory Syndrome-Like Coronavirus WIV1 Encodes an
Extra Accessory Protein, ORFX, Involved in Modulation of the Host Immune
Response(蝙蝠类SARS冠状病毒WIV1编码一种额外的辅助蛋白ORFX,参与宿主免疫反应的调节)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4936131/
https://journals.asm.org/doi/10.1128/JVI.03079-15
注:这不是一篇功能增益研究论文,该论文未对WIV1进行功能增益性改造;论文记录表明,石正丽团队未发表过任何功能增益研究论文,未对任何病毒进行过功能增益性改造,未改造出过任何一种有人类致病能力的病毒。
石正丽团队研发出反向遗传系统(平台),首次人工合成冠状病毒的时间,比Ralph S. Baric团队晚了16年!
言归原题。
WIV1、rs3367是一对极度相似的“孪生”蝙蝠冠状病毒。二者全基因组序列的同一性或相似度为99.92%
;在决定物种感染能力及宿主范围的S蛋白S1亚基部分,二者氨基酸序列同一性为100%。在不同论文中,有时使用rs3367,有时则使用WIV1,它们可以相互替代,不会对论文产生任何实质影响。为描述方便,我本人的文章经常将它们视为同一病毒。
无独有偶,“孪生”蝙蝠冠状病毒还有一对:WIV16与Rs4874,二者全基因组序列同一性为99.93%。WIV1(rs3367)、WIV16(Rs4874)发现于云南同一蝙蝠洞穴,这两对“孪生”病毒之间也非常相似,WIV1与WIV16全基因组序列的一致性(相似度)为97.54%;特别是,两对双胞胎RBD的五个关键氨基酸完全相同,这意味着它们的ACE2结合能力,宿主细胞进入(感染)能力,宿主范围都高度相似。
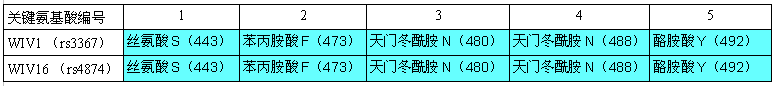
WIV1(rs3367)、WIV16(Rs4874)刺突蛋白RBD五个关键氨基酸对照表。
WIV1 spike GenBank ID:AGZ48828,WIV16 spike GenBank ID:ALK02457。
WIV1通过ACE2受体进入(感染)人体细胞,新冠病毒感染人体的核心受体也是ACE2。虽然大家都知道ACE2,但我要再罗嗦一嘴。
ACE2,即Angiotensin
Converting
Enzyme2,血管紧张素转换酶2,肾素-血管紧张素系统(RAS)中的关键蛋白酶之一。ACE2是细胞表面的一个跨膜糖蛋白,广泛存在于脊椎动物的呼吸、消化、血液、泌尿、生殖、视觉等系统的各个器官、组织内。ACE2可介导与之发生结合的病毒进入它所嵌附的细胞内部,常被称为ACE2受体。
WIV1、rs3367是非常非常特殊、非常非常奇特的蝙蝠冠状病毒。
绝大多数蝙蝠冠状病毒不能进入(感染)人体细胞,它们的刺突蛋白不能结合hACE2(human
ACE2);WIV1、rs3367却具有人体细进入(或者说感染)能力,它们的刺突蛋白能够结合hACE2,能通过这种结合,介导病毒进入(感染)人体细胞。可结合hACE2,可进入(感染)人体细胞,这是它们的第一个特别之处。
刺突蛋白可结合hACE2,具有人体细胞进入(感染)能力的特殊蝙蝠冠状病毒已知共(约)有7种,其中5种是:rs3367、WIV1、WIV16、rs4874、SHC014(即rsSHC014)。前四种本文刚刚提及,第5种--SHC014在我之前的文章中已多次出现,后续文章还会提及。
WIV1、rs3367的第二个特别之处是:虽然能够进入(感染)人体细胞,但它们不会使人发病,不会使人体产生任何疾病症状。虽然本身是人类无害的,但是,将它们刺突蛋白的全部或部分嫁接、嵌合到有致病能力的病毒骨架上(如SARS),将能改造出新的有人类致病能力的危险病毒,参照其刺突蛋白的结构改造某些病毒,也能改造出有人类致病能力的危险病毒。
WIV1、rs3367还有第三个特别之处。。。
II、 新冠、WIV1(rs3367)高度相似的强大跨物种感染能力,高度相似的宿主范围
WIV1、rs3367的第三个非同寻常之处是:它们具有强大的跨物种感染能力,它们的刺突蛋白能够结合众多脊椎动物的ACE2,它们能够进入(感染)众多物种的细胞,在新冠病毒出现前,WIV1、rs3367是已知的跨物种感染能力最强的冠状病毒(另一对孪生病毒WIV16、Rs4874的跨物种感染能力应该与WIV1、rs3367相当),已确认的可被它们感染的动物(含人类)至少有以下10种(类):
人类、果子狸、貉、非洲绿猴、恒河猴、雪貂、水鼬(即水貂)、猫、蝙蝠(包括菊头蝠、果蝠等翼手目动物)、老鼠(它们能使实验小鼠产生轻度疾病症状)。
强大的跨物种感染能力使WIV1、rs3367成为功能增益研究、冠状病毒功能增益改造的绝佳原材料、绝佳参照物。
新冠病毒的跨物种感染能力又如何呢?
新冠病毒的跨物种感染、传播能力极为强大、惊人!已确认的,或已报告的可被新冠病毒感染的动物包括:
人类、灵长类动物(如大猩猩、非洲绿猴、恒河猴、食蟹猕猴、狒狒、黑长尾猴和狨猴)、穿山甲、狗、猪、兔子、某些鼠类(如仓鼠、田鼠)、鼬类或貂类(如雪貂、水貂、水獭、黄鼠狼等等)、家猫、老虎、狮子、雪豹、麝香猫、北美鹿(如白尾鹿)、貉、树鼩、果蝠等等。


新冠病毒的感染名单看上去比WIV1(rs3367)长得多,这是否说明新冠的跨物种感染能力比WIV1(rs3367)强大得多呢?并非如此,这主要是研究、确认的不对等造成的,因为对WIV1、rs3367物种感染能力所做的研究、确认远少于新冠;还有一个原因,WIV1、rs3367很少使被感染的动物发病或产生症状,不专门、细致地研究、实验,很难发觉它们对某种动物的感染能力。WIV1、rs3367可感染的动物绝不会只限于前述10种,我的推测是,WIV、rs3367的跨物种感染能力可能还稍胜新冠。
WIV1(rs3367)已知的感染名单是:
人类、果子狸、貉、非洲绿猴、恒河猴、雪貂、水鼬(水貂)、猫、蝙蝠、老鼠。
将这一名单与新冠的感染名单比对,不难发现,WIV1(rs3367)能感染的物种,几乎全都包含在新冠的感染名单中,唯一的例外是蝙蝠。WIV1(rs3367)既能感染菊头蝠,也能感染果蝠;新冠病毒能感染果蝠,但对众多蝙蝠冠状病毒的宿主菊头蝠,新冠的感染能力很弱(这是新冠来自蝙蝠的一个反证)。还要说明一下果子狸和麝香猫的情况,已知WIV1(rs3367)能感染果子狸,而新冠能感染麝香猫;果子狸和麝香猫同属灵猫科,它们的ACE2高度相似,可以推断,WIV1(rs3367)、新冠都能感染果子狸和麝香猫。
进而可作出如下推断:新冠与WIV1(rs3367)的宿主范围高度雷同。
新冠病毒的跨物种感染(、传播)能力如此强大、惊世骇俗,这只是自然演化的偶然吗?新冠、WIV1(rs3367)的跨物种感染(、传播)能力都极为强大,这只是巧合吗?新冠与WIV1(rs3367)的宿主范围高度雷同,这又是巧合吗?
既非偶然,也不是巧合,它们是内在的结构原因决定的。什么结构原因?新冠与WIV1(rs3367)的某一结构是高度关联、高度等价的。新冠的什么结构与WIV1(rs3367)高度关联、高度等价?就是决定ACE2结合能力,决定细胞进入能力,决定宿主范围的刺突蛋白RBD的5个关键氨基酸。
III、 冠状病毒刺突蛋白RBD的5个关键氨基酸
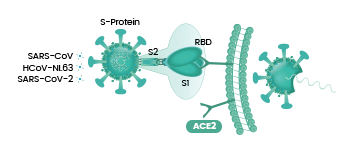
能否感染(即进入)细胞,取决于病毒有没有能打开“细胞锁”的钥匙。冠状病毒的钥匙是它的刺突蛋白(即Spike蛋白,S蛋白),而细胞的锁,就是嵌在细胞膜上的各种受体,如ACE2,TMPRSS2(跨膜丝氨酸蛋白酶2),CD4(表面抗原分化簇4糖蛋白)等等。
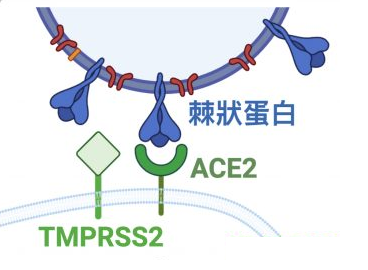
冠状病毒的细胞钥匙--刺突蛋白包括相连的两个部分--两个亚基,朝向外部的是S1蛋白,S1蛋白与病毒包膜之间是S2蛋白。S2蛋白也叫膜融合亚基(参与某些病毒如新冠病毒与细胞的膜融合),它相当于钥匙的手柄部分;S1蛋白也叫受体结合亚基,它负责与细胞表面的受体结合,相当于钥匙的齿面部分。S1蛋白中有一个区域叫做受体结合域(Receptor
Binding Domain),简称RBD,RBD是S1蛋白与细胞受体发生接触的部分,相当于齿面上的钥齿区域。
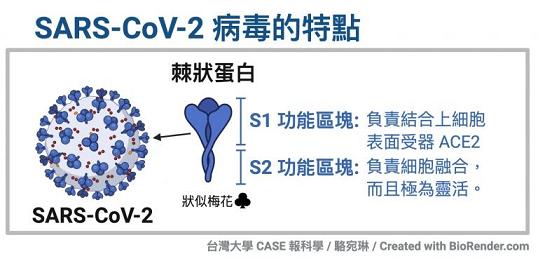
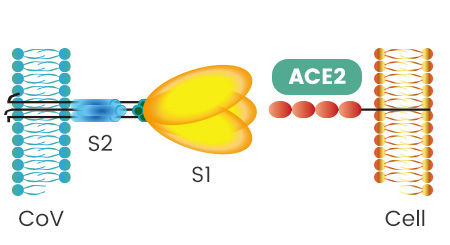
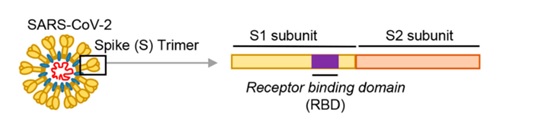
SARS病毒、新冠病毒感染细胞所用的核心受体都是ACE2(还有其它辅助受体)。冠状病毒刺突蛋白S1亚基RBD中,与ACE2能发生直接接触的氨基酸(残基)有14个,这14个氨基酸中,有5个起决定性的作用,它们决定刺突蛋白能否与ACE2结合,进而决定冠状病毒能否进入(感染)细胞。这5个关键氨基酸也是决定或影响冠状病毒宿主范围的最重要因素,它们相当于冠状病毒刺突蛋白钥匙上的关键钥齿。
如果5个关键氨基酸与ACE2适配,那么,刺突蛋白就能与ACE2成功结合,细胞的ACE2锁就“打开”了,冠状病毒将在ACE2的介导下,整体进入(感染)ACE2所嵌附着的细胞,或在膜融合(病毒包膜与细胞膜融合)后直接向细胞内释放其RNA。
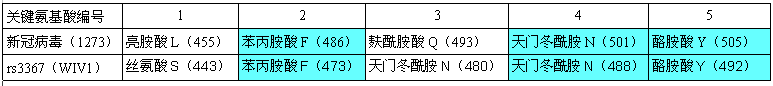
经过上述准备,现在可以说明、解答如下问题了:新冠的关键氨基酸,与WIV1(rs3367)的关键氨基酸,到底存在着怎样的高度关联?
IV、 新冠、WIV1(rs3367)关键氨基酸的高度关联、高度等价
下表展示了新冠、rs3367(WIV1)5个关键氨基酸的对应关系。表格中关键氨基酸的表达格式为:氨基酸名称-字母缩写-(氨基酸序号)。如,第二行第二列的亮胺酸L(455),表示新冠病毒的第一个关键氨基酸--亮胺酸(字母缩写为L),是新冠病毒的刺突蛋白氨基酸序列中的第455个氨基酸(残基)。
注:新冠病毒刺突蛋白的“长度”有两种情况:一类毒株的刺突蛋白包含1273个氨基酸(残基),另一类则包含1269个氨基酸(残基),1273刺突蛋白相比1269刺突蛋白前面多出4个氨基酸,(不考虑其它变异情况)二者后面的氨基酸没有差异,只是序号相差4。上图对应前一种情况;当采用后一类毒株时,新冠的关键氨基酸保持不变,但它们的序号都要-4。
由图可见,新冠、rs3367(WIV1)的5个关键氨基酸有三个是一样的:
它们的第五、第四、第二关键氨基酸同为酪氨酸Y、天门冬酰胺N、苯丙胺酸F。
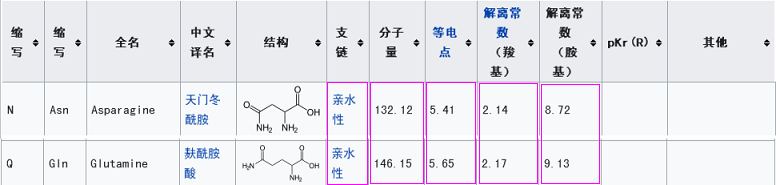
新冠的第三关键氨基酸是麸酰胺酸Q,rs3367(WIV1)的第三关键氨基酸是天门冬酰胺N。这两个氨基酸之间有什么玄机吗?有,它们的多项理化属性“碰巧”非常相似或接近,这意味着,在刺突蛋白与ACE2结合时,它们所起的作用是高度等价或高度等效的。
至此可知,新冠的5个关键氨基酸,与WIV1(rs3367)的5个关键氨基酸高度关联:三个雷同,一个高度等价。
这可能是自然演化的结果吗?绝无可能!
第一,WIV1(rs3367)与新冠全基因组序列的一致性(相似度)仅为82.13%,在自然演化关系上,它们相距一千个银河系;
第二,新冠有furin酶切位点,如果它是蝙蝠冠状病毒自然演化产生的,那么它的较近祖先应该是一个有furin酶切位点的蝙蝠冠状病毒,然而,已知的所有蝙蝠冠状病毒都没有furin酶切位点!
第三,新冠基因序列中有天然病毒中极为罕见的双CGG密码子(密码子指三个核苷酸碱性对的短序列),然而,从未在任何蝙蝠冠状病毒基因序列中发现过的双CGG密码子;
第四,新冠刺突蛋白中有一个精巧的三关节式绞链结构,然而,从未在其它病毒中发现过近似的结构;
第五,新冠还具有多项“源自”非冠状病毒科病毒的结构或功能,如:刺突蛋白S1亚基中具有免疫破坏功能的gp120蛋白、Gag蛋白,S1亚基、S2亚基交接处具有免疫屏蔽功能的O-Linked聚糖结构,N蛋白中具有免疫抑制、免疫干扰功能的nsp3A编码,以及逆转录自身RNA为cDNA,并将其整合到人体被感染细胞DNA中的功能。。。这些结构、功能分别来自逆转录科、丝状病毒科、黄病毒科、微小病毒科等科属的某些病毒,这些结构、功能中的任何一项,已知的蝙蝠冠状病毒无一具有!已知的冠状病毒无一具有!这些结构、功能中的任何一项,都是自然演化难以跨越的天堑!
参考文章:新冠病毒是自然产生或无意人为促生的吗?
新冠病毒绝不可能是自然演化产生的,它是对不同科属的多种病毒广为借鉴,人为精心设计的跨科属的病毒集大成者。
新冠与WIV1(rs3367)关键氨基酸的高度关联、高度等价也是人为设计的结果:有人参照WIV1(rs3367)的5个关键氨基酸,通过重用+等效或等价替代,设计出了新冠病毒的5个关键氨基酸。由于人为设计出的新冠病毒的关键氨基酸,与WIV1(rs3367)的关键氨基酸高度等价或等效,才产生了两个貌似的“巧合”:
1)新冠的跨物种感染、传播能力与WIV1(rs3367)高度相似、极为强大;
2)新冠与WIV1(rs3367)的宿主范围高度雷同。
参照WIV1(rs3367)设计新冠病毒5个关键氨基酸对顶级病毒学家来说算不上高难设计,不计摸索、反复等细节,设计工作可通过以下三个步骤完成:
1)直接复用WIV1(rs3367)的3个关键氨基酸:第五关键氨基酸--酪氨酸Y,第四关键氨基酸--天门冬酰胺N,第二关键氨基酸--苯丙胺酸F;
2)用理化属性非常相似、接近的麸酰胺酸Q替代WIV1(rs3367)第三关键氨基酸--天门冬酰胺N,以麸酰胺酸Q作为新冠的第三关键氨基酸;
3)最后为新冠选择第一关键氨基酸。选拔原则是:入选氨基酸应与已确定的四个关键氨基酸最配套,使新冠5个关键氨基酸与WIV1(rs3367)的5个关键氨基酸在整体空间结构上高度同构,或者,在与ACE2结合时高度等价、等效。使用相关软件,通过空间结构模拟、ACE2结合模拟,且、或通过实际的ACE2结合实验,在20种常见氨基酸中,选出亮氨酸L,以之为新冠病毒的第一关键氨基酸。
新冠关键氨基酸设计结束。
谁参照WIV1(rs3367),通过氨基酸重用+替代,设计出了新冠病毒的5个关键氨基酸?
有没有人同时深入研究过WIV1(rs3367)和关键氨基酸?
有,有人不仅同时深入研究过WIV1(rs3367)和关键氨基酸,还符合以下五个条件:
1)反复、深入研究过WIV1(rs3367);
2)“无数次”研究过冠状病毒刺突蛋白RBD的关键氨基酸;
3)有着长期的,极为丰富的功能增益研究经验、病毒改造经验;
4)曾多次对关键氨基酸进行改造、替代实验,并改造、培育出了可跨物种传播的,可感染人类和灵长类动物的冠状病毒;
5)曾以WIV1(rs3367)为原材料,改造出了有人类致病能力的危险病毒。
这个人是谁?Ralph S. Baric。Ralph S. Baric(或其团队)不仅符合以上五个条件,而且极可能是唯一符合以上五个条件的人(或团队)。
(未完待续)
|
