接续:新冠病毒溯源九问(中)
众多证据、线索指向同一个结论:Ralph S. Baric(拉尔夫·巴里克)就是新冠病毒的核心设计者;同时,也有迹象、线索显示,新冠病毒并非出自单一团队之手,新冠病毒有部分结构、功能,是巴里克团队外的其它联合设计者设计、引入的。
(一)拉尔夫·巴里克与新冠的逆转录
新冠病毒的逆转录特性
新冠病毒具有如下逆转录特性:它的RNA能逆转录为cDNA,并整合到人体被感染细胞的DNA中。
cDNA,即Complementary DNA,是RNA的互补DNA,有时也叫做RNA的DNA拷贝,或RNA的对应DNA。
什么是逆转录呢?以DNA为模板转录出对应RNA的过程,叫(正)转录(transcription);相反,以RNA为模板转录出对应DNA的过程,就叫做逆转录(reverse transcription)或反转录。
更通俗地说,照着DNA制作RNA,是转录,反之,照着RNA制作DNA,就是逆转录。
新冠病毒的逆转录特性有两个论文依据。
论文依据一
2021年5月25日,麻省理工学院(MIT)、怀特黑德生物医学研究所、国家癌症研究所等机构的一组科学家,包括干细胞生物学家Rudolf
Jaenisch教授、基因调控专家Richard Young教授,以及Liguo
Zhang等人,在PNAS(美国国家科学院院刊)上发表了如下论文:
Reverse-transcribed
SARS-CoV-2 RNA can integrate into the genome of cultured human cells
and can be expressed in patient-derived tissues
(逆转录的新冠病毒RNA 能整合到培养的人类细胞的基因组中,并能在患者组织中检测到)
https://www.pnas.org/content/118/21/e2105968118
论文指出:
1、新冠病毒能够利用人体内源性逆转录转座子LINE-1 (long interspersed nuclear elements-1,长散布核元件-1),将其RNA片断逆转录为cDNA片断并整合到被感染细胞的DNA中;
论文展示了研究中检测到的,嵌有新冠cDNA序列的人体DNA嵌合序列,如下图:

该嵌合序列是使用 Nanopore(纳米孔) 测序测得的。图中,
蓝色部分是人类原有的基因组序列;
洋红色部分是嵌入人类基因组的新冠全长NC亚基因组序列(序列中有省略号);
黄色部分是LINE-1逆转录转座子的特征序列,其中,黄色+下划线部分是LINE-1核酸内切酶的识别序列。
NC:nucleocapsid,核衣壳; NC 亚基因组是编码核衣壳蛋白(nucleocapsid protein)的RNA子序列。
2、新冠病毒还可使用LINE-1之外的其它内源性逆转录机制,如使用内源性IAP(intracisternal A-type particle,颅内A-型粒子)逆转录元件实现其RNA在人体内的逆转录与整合;
3、在急性感染细胞中,在重症患者的支气管肺泡灌洗液
(BALF)
中,都检测到了嵌有新冠cDNA的人类DNA。虽然在急性感染细胞中检测到的新冠cDNA比例极低,不超过组织样本中新冠RNA总量的千分之一(这或许可以理解为,逆转录过程是比较滞后的),但在新冠重症患者的支气管肺泡灌洗液中,以及在新冠死亡患者的尸检样本中,检测到的新冠cDNA的比例可高达40%~50%。
4、检测到的,逆转录产生的、嵌入到人体DNA中的cDNA序列主要对应新冠RNA 3' 端的亚基因组序列(包括编码核衣壳蛋白NC亚基因组序列),
这些整合到人体DNA中的新冠基因组片断不能在人体中组装出有生物活性(传染能力、复制能力)的新冠病毒。
5、嵌入人体DNA的新冠cDNA片断在人体内转录出的RNA片断,会使新冠PCR检测呈阳性,这应该是如下现象的内在原因:许多新冠患者在康复数周乃至数月后,其PCR检测仍持续、反复呈阳性,显示其体内有新冠RNA,但在其体内却检测不出新冠病毒。
论文依据二
2021年2月25日(发表时间早于论文一),华中科技大学(同济医学院)的Ximiao
HE教授、Li-quan Zhou教授等四位中国科学家在Frontiers in Cellular and Infection
Microbiology(《细胞与感染微生物学前沿》)期刊上发表了一篇论文:
Exogenous Coronavirus Interacts With Endogenous Retrotransposon in Human Cells
(外源性冠状病毒与人类细胞内源性逆转录转座子的相互作用)
https://www.frontiersin.org/articles/10.3389/fcimb.2021.609160/full
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7959850/
这篇论文探讨了多个课题。论文的如下部分深入研究了新冠病毒的逆转录特性:
SARS-CoV-2 RNA May Form Chimeric Transcripts With Retrotransposon RNA Especially LINE for Potential Insertion Into Host Genome
(新冠病毒RNA 可以与某些反转录转座子,特别是LINE转座子形成嵌合转录本,导致对宿主基因组的潜在插入)
论文指出:
1、冠状病毒不应自行整合到宿主基因组中;
2、新冠病毒的RNA能够嵌合到人类基因组中;
下图展示了研究者检测到的,嵌入人体DNA中,分别与人体基因组三种特征序列(3'-UTR、LINE、SINE)相连接的新冠序列片断(图中蓝色部分)。

3'-UTR:three prime UnTranslated region,3'非转译区,是信使核糖核酸(mRNA)中,紧接在编码区之后的一段控制序列,该段序列不被翻译为蛋白。
LINE的全称见论文一,SINE的全称稍后给出。
3、新冠基因与人类TE基因嵌合的效率远高于它与人类非TE基因嵌合的效率(这应该可以理解为,新冠RNA与人类基因组的嵌合通常都有TE元件参与或介入);
TE:transposable element,转座子或跳跃子,一类能够通过转录或逆转录,复制、剪切、粘贴到基因组其它位置的DNA序列片断。
4、LINE、SINE 和LTR 等类型的人类内源性转座子(TE)元件都能参与、介入新冠基因组与人体基因组的嵌合;对促成这种嵌合表现最高效的TE元件是LINE 家族,在LINE家族中,表现最高效的是LINE-1 逆转录转座子;
SINE:Short
interspersed nuclear
elements,短散布核元件,和LINE一样,也是一类non-LTR反转录转座子。这类反转录转座子没有长末端重复序列(non-long
terminal repeats,non-LTR),自身也没有转座酶或整合酶的编码能力,需要在细胞内既有的酶系统作用下进行转座。
LTR:long
terminal
repeats,是一类具有长末端重复序列的反转录转座子,包括Tyl-copia类和Ty3-gypsy类转座子。这类反转录转座子可以自行编码反转录酶(Reverse
transcriptases)或整合酶(integrases),自主地进行转录。LTR的转座机制与逆转录病毒相似,区别是,不能像逆转录病毒(如艾滋病病毒)那样以自由感染的方式进行传播。高等植物中的反转录转座子主要属于Tyl-copia类,分布十分广泛,几乎覆盖了所有高等植物种类。
5、在人类被感染细胞DNA中可以检测到新冠RNA不同位置的亚基因组(RNA子序列或序列片断)。在检测到的嵌入人体DNA的新冠基因片断中,新冠RNA后部的基因片断所占比例显著高于其它位置的基因片断(论文一提到的3'
端的NC亚基因组序列就位于新冠RNA的后部);
下图是对新冠感染的Calu-3 细胞(人类肺腺癌细胞系)进行相关检测的结果图。
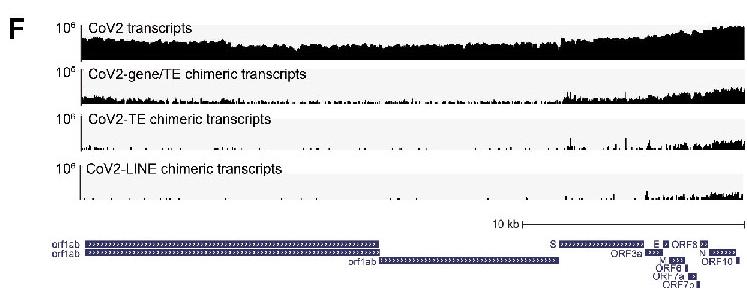
横坐标:新冠基因序列;
纵坐标:基因序列各个位置处新冠基因片断的检测数。
由上而下,
第一层:样本中不同位置处新冠基因片断的检测数,
第二层:新冠-人类嵌合基因中,不同位置处新冠基因片断的检测数,
第三层:TE相关的新冠-人类嵌合基因中,不同位置处新冠基因片断的检测数,
第四层:LINE相关的新冠-人类嵌合基因中,不同位置处新冠基因片断的检测数。
由图可见,新冠RNA后部的基因片断嵌入人体DNA的频率最高。
6、在NCBI
生物数据库(GenBank)人类基因组数据中检索不到匹配长度>=200bp的新冠病毒基因片断(即,人类基因组中不存在与新冠基因组一致,且长度>=200个碱基对的基因片断)。这表明,在人体DNA中检测到的新冠RNA片断是外来的,来自新冠病毒;而且,它们不应该是通过序列同源性识别进入人类细胞核并嵌入人类基因组(DNA)的,它们是逆转录并整合进入人类基因组的。
新冠的逆转录特性是人为设计的
将自身RNA逆转录为cDNA并整合到宿主基因组中,这原本是逆转录科病毒(如艾滋病病毒)的独特功能。由上述两篇论文可知,新冠病毒也具有类似的特性。但相比艾滋病病毒,新冠病毒的这一功能还不完善:嵌入到人体DNA中的艾滋病基因组能组装出具有感染、复制能力的艾滋病病毒,而嵌入到人体DNA中的新冠基因组不能组装出具有感染、复制能力的新冠病毒。
阅读、研究论文一、论文二之后,我又通读了这两篇论文引用的,与“非逆转录病毒基因组嵌入宿主基因组”有关的几篇论文,基于这些论文,可作出如下判断:
1、以往虽然数次报告过非逆转录病毒基因组嵌入宿主基因组的情况,但是,所涉及的病毒无一是冠状病毒,也就是说,在新冠出现前,从未报告过冠状病毒基因组嵌入宿主基因组的情况。
因此,从既有信息看,新冠病毒RNA可逆转录并整合入宿主基因组这一特性,在冠状病毒中是独一无二的,这是新冠病毒的又一个独一无二特性。
2、非逆转录病毒基因组片断嵌入宿主基因组的情况在自然界中发生的频率非常低(累积存在若干实例与发生频率非常低并不矛盾);然而,由论文一可知,在支气管肺泡灌洗液等人体样本中,新冠RNA发生逆转录、嵌合的机率可高达40%~50%,这对非逆转录病毒来说,是极为罕见、极不寻常的。
3、之前报告的嵌入宿主基因组的非逆转录病毒基因多为较短的基因片断,而新冠病毒则能将其整个NC亚基因组(核衣壳蛋白子序列,含1662个碱基对)完整嵌入人类DNA。在我印象中,除细小病毒科病毒外,其它非逆转录病毒应该没有报告过如此规模的嵌入。
可进一步作出如下判断:
1、新冠病毒应该具备一组相应结构,这组结构能与人体中的内源性逆转录转座子或逆转录酶协调、配合工作,使新冠RNA得以逆转录为cDNA并整合到人体细胞DNA中。
2、上述结构应该是新冠病毒独有的,因为其它冠状病毒都不具备新冠的逆转录、整合特性。
3、新冠病毒RNA逆转录为cDNA并嵌入人体DNA这一特性,不是冠状病毒自然演化产生的,因为除新冠外,没有任何一种冠状病毒表现出这一特性(从未有一种病毒象新冠病毒那样,能“自然演化”出不下五种独一无二的特性)。
4、新冠病毒的逆转录、整合特性,是人为设计出来的。有人赋予了新冠病毒利用人体的逆转录转座子、逆转录酶,逆转录自身RNA为cDNA,并将其整合到人体DNA中去的能力。如果他将这一逆转录功能设计得更完善的话,那么,新冠病毒将和艾滋病病毒一样,一旦感染,病毒基因就会固化在人体DNA中,一旦感染,人体DNA中的病毒基因就会源源不断地组装出新病毒,一旦感染,就无法彻底清除病毒及其基因、无法治愈。
谁设计了新冠的逆转录特性?
最大的设计嫌疑人仍然是拉尔夫·巴里克(Ralph S. Baric)。
为什么这么说?因为Ralph S. Baric是这个世界上最了解逆转录的人,是最频繁使用逆转录技术的人,是与新冠的逆转录特性渊源最深的人。
Ralph S. Baric2000年有一项重大发明:合成冠状病毒的反向遗传平台。
2000年11月,Ralph S. Baric领导的一个科学团队发表了一篇Journal of Virology论文:
Strategy for Systematic Assembly of Large RNA and DNA Genomes: Transmissible Gastroenteritis Virus Model
(大RNA和DNA基因组系统组装策略:传染性胃肠炎病毒模型)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC110934/
在这篇论文中,Ralph S. Baric等人使用反向遗传技术合成了猪传染性胃肠炎病毒(TGEV,Transmissible gastroenteritis virus,一种α谱系冠状病毒),并在培养细胞中收获了TGEV的活性毒株。
这是人类首次人工合成冠状病毒。冠状病毒是结构最复杂的一类病毒,其基因组在单链正极性RNA基因组中是最大、最长的,人工合成冠状病毒是一个非同寻常的科学创举。
论文明确指出:使用构建TGEV的反向遗传技术可以对冠状病毒基因组进行精确的基因改造。这其实意味着,可以使用反向遗传平台对冠状病毒进行无痕迹的设计、改造;而且,反向遗传平台使冠状病毒的设计、改造很大程度上简化为基因序列的设计、编辑。
Baric发明的反向遗传平台与新冠病毒的逆转录特性有什么关联呢?
论文一指出了新冠病毒的如下逆转录特性:
新冠病毒能利用人体内源性逆转录转座子将其RNA片断逆转录为cDNA片断,并整合到被感染细胞的DNA中。
反向遗传平台又有什么特点呢?
反向遗传平台的基本功能是,基于冠状病毒的基因序列(RNA序列)合成冠状病毒。用于合成冠状病毒的基因序列,可以是已知冠状病毒的基因序列,也可以是人为设计、人为改造过的基因序列。
反向遗传平台使用的最基本技术是逆转录技术,使用反向遗传平台合成冠状病毒时,必须经过以下步骤:
将冠状病毒的RNA序列分断,逆转录出各个RNA序列片断对应的cDNA片断,再将cDNA片断整合在一起,组装出冠状病毒的全长cDNA。
注:上述几个步骤,用一句话概括,就是基于病毒的基因序列(符号)组装病毒的遗传物质cDNA。
对照上面两段红色加黑内容,不难看出,新冠的逆转录、整合特性,与反向遗传平台逆转录、组装全长cDNA的过程,二者的工作内容、工作步骤极为相似。
反向遗传平台问世后,Ralph
S.
Baric几乎每篇论文都要使用该平台,使用逆转录技术合成冠状病毒,他研究、实验所用的冠状病毒,几乎都是使用反向遗传平台自行合成的。Ralph
S. Baric和逆转录打了近20年交道,对逆转录烂熟于胸,与逆转录亲密无间!
看几个Ralph S. Baric的论文标题。
2002年11月,Ralph S. Baric等人合成小鼠肝炎病毒(一种β谱系冠状病毒)A59株系的Journal of Virology论文:
Systematic Assembly of a Full-Length Infectious cDNA of Mouse Hepatitis Virus Strain A59
(小鼠肝炎病毒A59毒株全长传染性cDNA的系统组装)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC136593/
2003年10月28日,Ralph S. Baric团队、美国陆军传染病医学研究院(迪特里克堡实验室所属单位)、范德堡大学医疗中心合成SARS病毒的PNAS论文:
Reverse genetics with a full-length infectious cDNA of severe acute respiratory syndrome coronavirus
(SARS病毒全长传染性cDNA的反向遗传学)
https://www.pnas.org/content/100/22/12995
2013年10月1日,Ralph S. Baric团队合成MERS病毒(中东呼吸综合症冠状病毒)的PNAS论文:
Reverse genetics with a full-length infectious cDNA of the Middle East respiratory syndrome coronavirus
(MERS病毒全长传染性cDNA的反向遗传学)
https://www.pnas.org/content/110/40/16157
以合成MERS病毒的这篇论文为范例,我们直观、近距离的地“触摸”一下反向遗传平台的工作过程吧:
a. 将MERS-CoV的RNA序列分为7个片断,逆转录出每个RNA序列片断对应的cDNA片段,并在这些cDNA片断中插入识别标记;
b. 通过内切酶,将逆转录得到7个cDNA片段无缝组装为MERS病毒的全长cDNA;
c. 将全长cDNA转录为MERS的RNA(这次得到的是RNA遗传物质实体,不是序列符号);
d. 通过电穿孔将MERS的RNA释放到Vero细胞(非洲绿猴肾细胞系细胞)中;
e.
电穿孔后48-72小时内,在Vero细胞培养物中检测到了细胞病变效应,检测到了相当滴度(浓度)的带有识别标记(步骤a所加)的MERS病毒RNA及MERS-CoV毒株(rMERS-CoV)。这说明人工合成的MERS病毒RNA能够在Vero细胞内自我复制并组装出完整的MERS病毒毒株;
f. 将步骤e得到的MERS病毒毒株rMERS-CoV放入未被病毒感染过的Vero 81细胞培养物中,12小时后,可观察到细胞感染特征,这说明人工合成的MERS病毒RNA组装出的MERS病毒rMERS-CoV具有细胞感染能力及传染性;
g. 实验证明,rMERS-CoV还可感染并在纯化的原代肺泡II肺细胞、微血管内皮细胞、成纤维细胞等多种人体细胞中有效复制。
很可能,因为技痒,Ralph
S.
Baric抑制不住赋予新冠病毒逆转录能力的强烈冲动;但之后因为某些原因(后怕或良心不安),在实施了部分设计后,中途又将之搁置。因而,新冠病毒的逆转录功能是一个不完善的作品,其嵌入人体DNA中的基因组不能象艾滋病基因组那样,组装出有活性的病毒。否则,新冠将成为另一种不治之症。
(未完待续)
相关文章:
出自科学疯子之手的病毒集大成者(二)
出自科学疯子之手的病毒集大成者(一)
|
