接续:谁设计、制造了新冠病毒(三) 下
新冠疫情是天灾,还是人祸? 新冠病毒的来源真相,新冠疫情的产生真相不应是小圈子里的秘密。
新冠病毒来自实验室的证据有没有?多不多?充分不充分?
如果对新冠病毒具有,而其近亲病毒无一具有的众多结构、特性、能力,对新冠病毒与远支冠状病毒,与非冠状病毒,与其它生物、微生物如病菌、寄生虫、人类的众多不可思议的结构巧合,对直接指出或隐含这些证据、线索、疑点的科学论文、其它文章一直假装看不见,假装听不到,装聋作哑,对它们不分析、不发掘、不联系、不总结、不披露、不宣传(选择性地报道、披露、宣传新冠病毒的研究成果)、不讨论、不澄清,闪躲、回避、冷处理,令它们不能被广泛了解、认知;如果本应审视、探查所有可能性,本应不放过任何疑点、突破口,不忽略任何蛛丝马迹的调查者反其道而行之,阉割调查范围、调查对象、调查方向,一直施行存在明显缺陷、漏洞的溯源调查;如果调查者无意揭示真相,还原真相,把心思、功夫花在装糊涂、装模作样假作为、做表面文章、演戏,掩耳盗铃、糊弄公众、欲盖弥彰上,花在为自己原地打转、一无所获砌词卸责上;如果一直背对真相,大肆翻炒谎言、伪证、假象、不实之辞与鸡毛蒜皮,一直围着死胡同、迎着南墙来回折腾,来回兜圈子,对死胡同外面、南墙对面不闻不问,不置一词,绝不审视、调查那里早已存在的,越来越多、越来越明显的证据、线索、疑点、发现,绝不去捅窗户纸,绝不触及要害问题。。。那么,如我们现在所看到的,结论和结果就是,“调查”了三年之久一筹莫展、寸步不前,除了模棱两可、含糊其辞,没有其它交待,除了谎言、伪证、不实之辞,拿不出一样上得了台面,经得起推敲、检验的证据。
第四组证据概要
本系列之前的三组文章已经指出了一些新冠病毒具有的,其近亲冠状病毒无一具有的结构、能力、特性,以及新冠病毒与一些其它支系、谱系冠状病毒,与一些非冠状病毒的结构、能力、特性巧合。后续文章还将指出、介绍新冠病毒与其它生物、微生物(如人类、病菌、寄生虫等等)的诸多结构巧合或相似性。要说的事情很多,不过,本文和接下来几篇续文的焦点工作是,就揭示新冠病毒来源,就指证新冠病毒设计、制造者提供第四组证据,展开具体细节,出示论文依据、序列依据及其它依据。第四组证据由一组关联信息、巧合组成,概要情况如下:
1、新冠病毒S蛋白(刺突蛋白)S1/S2处(S1、S2亚基交界处,这是个很特别、很重要的位点)存在一个furin切割位点,这一结构对新冠的致病能力至关重要。然而,奇怪的是,与新冠病毒S蛋白序列相似度超过40%的冠状病毒,无一具有furin切割位点。
更令人震惊的是,新冠病毒S1/S2处的长furin切割序列在其它任何冠状病毒、非冠状病毒中都未发现过,但它却与人类ENaC-α (上皮钠离子通道的α 亚基)的长furin切割序列相同,新冠病毒S蛋白与人类ENaC-α的长furin切割序列都是RRAR'SVAS(ENaC-α是含有RRAR'SVAS序列的唯一人体结构)。以下是指出这一事实的论文插图。
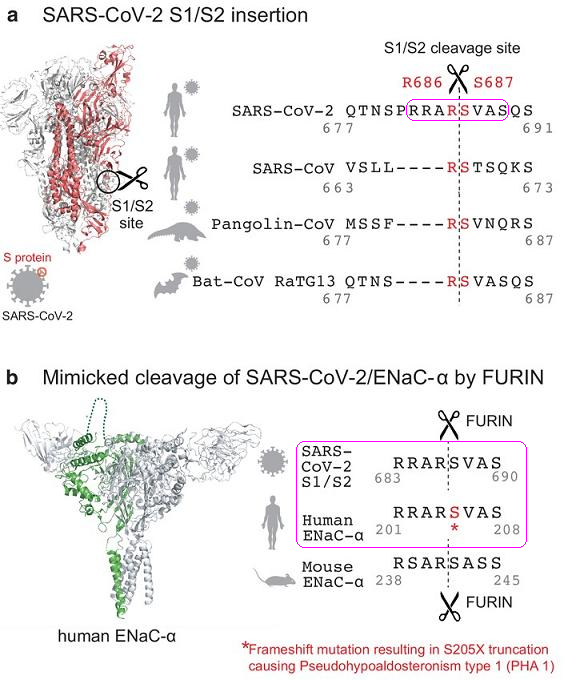
图A:新冠、三种新冠“近亲”S1/S2处的aa序列对照。aa: amino acid,氨基酸。
图B:新冠S蛋白、人类ENaC-α、小鼠ENaC-α的长furin切割序列对照。
论文依据一:
SARS-CoV-2 strategically mimics proteolytic activation of human EnaC
(SARS-CoV-2策略性地模拟人ENaC的蛋白水解激活)
https://elifesciences.org/articles/58603
论文依据二:
A call for an independent inquiry into the origin of the SARS-CoV-2 virus
(呼吁对SARS-COV-2病毒的起源进行独立调查)
https://www.pnas.org/doi/10.1073/pnas.2202769119
这一结构巧合可能使新冠病毒的刺突蛋白得以在细胞表面冒充、利用、竞争、劫持人类ENaC-α在furin蛋白酶作用下的水解和激活(ENaC需要其α亚基和γ亚基在蛋白酶作用下水解切割以激活其功能)。
相比其它furin切割序列,拥有与人类ENaC-α相同的furin切割序列将使刺突蛋白更顺利、高效地被人体furin蛋白酶水解切割和激活,从而有效提升新冠病毒的感染(即细胞进入)效率。
注:水解切割后与S1亚基分离,暴露在细胞膜表面的S蛋白S2亚基将激活膜融合介导能力,介导病毒包膜与细胞膜发生膜融合,使包膜内的病毒RNA第一时间释放到细胞内,迅速展开病毒复制;如果病毒没有furin切割序列,或者细胞表面缺乏furin蛋白酶,那么,完成受体结合后病毒将被整体吞入细胞,“胞吞”后还要经历其它过程以实现RNA脱壳、释放。“胞吞”感染的病毒复制远比“膜融合”感染迟滞,新冠病毒(“膜融合”方式感染)的感染、复制效率是SARS(“胞吞”方式感染)的10~100倍。
与人体ENaC竞争furin蛋白酶,或劫持ENaC所需的furin蛋白酶将造成ENaC功能紊乱、失常,引发一些次生疾病(ENaC紊乱的症状包括高血压,低血钾,肾脏水、钠潴留,代谢性碱中毒等等,新冠感染会造成ENaC紊乱、失常,但产生哪些具体症状,尚不明确),这些症状又可能与新冠病毒的其它致病能力相互作用,引发更复杂或更严重的病症。
注A。RRAR'SVAS或RRARSVAS代表包含八个氨基酸(残基)的氨基酸序列,用中文描述即:精氨酸-精氨酸-丙氨酸-精氨酸-丝氨酸-缬氨酸-丙氨酸-丝氨酸,序列中间额外添加的符号“'”代表furin(弗林)蛋白酶的切割位置,在新冠病毒中,它也标志S蛋白的S1亚基和S2亚基的分界线。R、A、S、V分别是精氨酸、丙氨酸、丝氨酸、缬氨酸的单字母缩写。
注B。ENaC即Epithelial
Na+ Channels(上皮钠离子通道),也叫做Epithelial Sodium Channel
(上皮钠通道),它分布于脊椎动物肺、呼吸道(鼻腔、气管、支气管)、肾脏、结肠等器官的上皮组织中,它的基本功能包括调节机体钠吸收,调节上皮组织表面液量、调节血压等等。ENaC包含三个结构相似的亚基(亚结构)α、β
、γ,一个ENaC通道单元由两个α亚基、一个β亚基和一个γ亚基构成。
2、新冠S蛋白与人类ENaC-α的上述结构巧合是不可思议的,因为二者共有的RRAR'SVAS序列在(广义)生物界极度罕见。除新冠病毒外,其它冠状病毒S蛋白皆不含有RRAR'SVAS序列;在人体中,RRAR'SVAS序列只存在于ENaC-α的aa(amino acid,氨基酸)序列中,即ENaC-α是(aa序列)含有RRAR'SVAS序列的唯一一种人体结构;ENaC-α含有RRAR'SVAS序列的生物物种仅有六种,其中五种是灵长类动物:人类、黑猩猩、矮黑猩猩、猩猩、大猩猩,另外一种是发现于欧洲和西亚的一种叫作pipistrellus kuhlii的蝙蝠。
为什么偏偏是新冠病毒“自然演化”出了生物界极度罕见,冠状病毒中独一无二,病毒界独一无二,“恰巧”与人类ENaC-α共有的长furin切割序列,这一序列为什么又恰好“自然演化”产生在S蛋白的S1/S2处这一特殊而重要的位点(新冠病毒共有近三万个核苷酸位点),如此精准、惊人、有目的的“自然演化”是史无前例的!
新冠病毒S蛋白S1/S2处与人类ENaC-α共有的长furin切割序列有没有人为设计的可能?是什么人借鉴人类ENaC-α,为新冠病毒引入、设计了这一结构?
3、某著名大学N有一座肺研究所,该所有一批长期研究ENaC的生物化学--分子生物学顶尖专家,该所在2001年至2018年间至少发表了七篇专门研究ENaC(微观结构与机能)的分子生物学-生物化学论文,同一期间该所还发表了其它一些与ENaC高度相关的论文。
4、N大学还有一位被誉为“冠状病毒合成之父”的全球冠状病毒顶级研究权威B,B是该大学流行病学系教授兼微生物学与免疫学系教授。疫情发生后的2021年4月,B教授入选该国国家科学院院士,次年4月,B教授又当选该国艺术与科学院院士(该国国家科学院、该国艺术与科学院是两个不同的科学团体、组织)。
5、N大学B教授领导的冠状病毒研究团队与N大学肺研究所的研究人员经常合作研究,共同著述论文,双方交流非常频繁,关系非常密切。
4.1、B教授情况的一些补充说明:
B教授研究冠状病毒近40年,发表冠状病毒论文二百余篇。2000年,B教授等人发明了基于基因序列合成冠状病毒的反向遗传平台,人类历史上首次在实验室中合成、复活了冠状病毒。反向遗传平台的基本功能是:基于冠状病毒的基因序列即能合成、复活冠状病毒;该平台的基本工作过程是:基于基因序列,分段合成、组装出基因序列对应的病毒基因物质—基因组cDNA(RNA的互补DNA)、RNA,而后将病毒RNA(通过电穿孔)注入培养细胞(如Vero E6),利用RNA复制收获具有复制、感染活性的冠状病毒毒株(疫情发生后,瑞士伯尔尼大学的科学家基于已上传的新冠病毒基因序列合成、复活新冠病毒,使用的是与上述反向遗传平台工作原理相同的反向遗传技术。很少有人知道,基于基因序列合成、复活冠状病毒的技术,早在2000年就已发明问世了)。B教授因这一发明,因职业生涯使用该平台合成过难以计数的冠状病毒而被誉为“冠状病毒合成之父”。相比之下,中国的武汉病毒研究所直到2016年才研发出相同功能的基于基因序列合成冠状病毒的反向遗传系统,比B教授晚了16年。
注意,基因序列是由a、g、c、t四种碱基符号组成的一个文本字符串(a、g、c、t依次对应腺嘌呤、鸟嘌呤、胞嘧啶 、胸腺嘧啶),序列中的每个字符表示、对应基因组物质--DNA或RNA中的一个核苷酸(核心结构为碱基)。有必要强调以下事实:使用反向遗传平台合成、复活冠状病毒所需的,只是基因序列这一文本字符串,有了这一文本字符串,就能使用反向遗传平台合成、收获冠状病毒毒株。用于合成、复活冠状病毒的基因序列,可以是已知冠状病毒的基因序列,也可以是简单编辑、修改,或复杂设计得出的一个全新的基因序列。
发明反向遗传平台使B教授摆脱了对病毒原材料—天然冠状病毒毒株的依赖,他的团队不需要从从病毒原产地获得毒株,他们需要的只是病毒的基因序列,只要从生物基因数据库查得所需冠状病毒的基因序列,就能使用反向遗传平台将其合成、复活(部分新发现的信息尚未入库的蝙蝠冠状病毒的基因序列是发现者应B教授要求专门向其提供的,在一篇著名的嵌合病毒论文中,B教授将基因序列的提供者S.Z.L礼节性地列名为第十四作者,尽管S.Z.L只是向其提供了蝙蝠冠状病毒SHC014基因序列,而根本并未参与相关的病毒嵌合改造研究和实验)。作者查阅过众多B教授(2000年后的)论文,这些论文所用的原材料冠状病毒毒株,所改造产生的冠状病毒毒株,全都是使用反向遗传平台合成、复活的,这些论文都有专门的章节(“Materials and Methods”中的相应子章节)描述基于已有基因序列及编辑、设计所得的新基因序列合成病毒基因组、复活病毒毒株的具体过程。
使用反向遗传平台可以无痕迹、高度便利、高度自由地编辑、改造冠状病毒(无须依赖单一的病毒骨架或单一的病毒模板)。在冠状病毒结构规则允许的范围内,能够高度自由地修改(插入、删除、替换)基因组中的单个核苷酸、单个氨基酸或一段核苷酸序列、一段氨基酸序列;能够将多个冠状病毒的基因组片断拼接成一个整体;既可以在冠状病毒基因组中插入其它冠状病毒的基因片断,也可以插入非冠状病毒的基因片断,还可以插入其它生物(如病菌、寄生虫、动物和人类)的基因片断。反向遗传平台大大降低了冠状病毒改造的难度,大大提升了冠状病毒改造的效率和便利程度,它使冠状病毒的改造、冠状病毒的基因编辑很大程度上简化为基因序列的文本编辑。
B教授是功能增益研究的坚定支持者、执着的冠状病毒功能增益改造长期身体力行者。2014年10月17日,其所在国颁布了三类病原体(SARS、MERS、流感)功能增益研究暂停令,B教授对此大为不满,他给国立卫生研究院写了一封长信,声称暂停令严重影响冠状病毒研究,严重影响科学界对未来疫情作出有效应对。暂停令生效期间,经过申请和国立卫生院的特批,B教授仍然完成了两项SARS相关的冠状病毒功能增益改造研究并发表了论文。2017年12月19日,其所在国撤销了功能增益研究暂停令,全面重启了危险病原体功能增益研究。两年后的2019年12月,新冠疫情爆发。
5.1、B教授与肺研究所关系的一些补充说明:
最新资料显示,肺研究所隶属于N大学医学院,B教授则同时分属N大学医学院(含微生物学和免疫学系)和公共卫生学院(含流行病学系),即B教授与肺研究所同属N大学医学院(不同时期该校院、系,院、所的名称、隶属关系可能有所不同)。
肺研究所的研究内容与B教授团队的研究内容高度相关、相辅相成。肺、呼吸道的生理结构、生理机制、发病机制是肺研究所的重点研究内容,而B教授团队研究对象—大多数冠状病毒的首要感染部位,也正是肺、呼吸道。
双方拥有共同的成员/职员(接口人),B教授团队有成员来自肺研究所,该成员不是调离原单位转入新单位,而是继续在肺研究所工作,同时又进入B教授所在的微生物学和免疫学系工作,在N大学内跨系所任职。(至少)在2005~2016年期间,该接口人同时/交叉参与了肺研究所与B教授团队的多项科学研究,在双方多篇论文中,此人要么是署名作者之一,要么其贡献在论文中被专门提及。
肺研究所的其它一些成员也经常参与B教授团队的冠状病毒研究,或者成为相应论文的署名作者,或者其贡献在论文中被专门提及。
在冠状病毒改造研究中,B教授团队试验病毒对人体组织、人体细胞感染、致病能力(体外实验)所使用的人体肺脏、人体气道上皮组织样本、培养物,以及人类肺泡上皮细胞、气管支气管上皮细胞的培养物,通常都由肺研究中心提供(来自相关手术或病人捐献)或代为购买;
B教授团队还使用人源化小鼠模拟试验(改造)病毒对人类活体的感染、致病能力(体内实验)。人源化小鼠是拟人化的转基因小鼠,其肺、脑、肝、肾和胃肠道等部位的细胞跨膜受体ACE2由鼠ACE2(mACE2,mouse ACE2),转基因为人ACE2(hACE2,human ACE2)。转基因小鼠还可用于对比试验病毒跨物种的活体感染、致病状况。
B教授团队在冠状病毒改造研究中使用的人源化小鼠基于肺研究所下属动物模型核心(The Animal Models Core)设计、研发的转基因小鼠,前者是对后者上进一步基因改造而获得的。
上述情况,元芳,你怎么看?
新冠病毒S蛋白S1亚基、S2亚基交界处与人类ENaC-α 共有的,在病毒界独一无二、在生物界极度罕见的长furin切割序列RRAR'SVAS,是自然进化、自然演化产生的,还是人为引入、人为赋予的?
(未完待续)
|
