接续:“万能”受体适配器--新冠S蛋白 0
有些事实需要回避,不便公开申明、反复强调,不便广而宣告,广为讨论,那等于将真相搬出隐蔽、黑暗的角落,摆放到没有遮蔽的阳光下。
新冠病毒具有泛器官、泛组织感染、破坏能力,新冠病毒能够感染、损伤几乎所有的人体器官、人体组织。未见权威组织、权威人士专门指出、明确强调这一点,但人们能够从新冠致病情况的纷纭报道中自行总结出这一事实。已论文报告或媒体报道的新冠病毒感染、致病部位遍及人体的呼吸系统、消化系统(包括胃肠道、肝脏、胰腺)、血液循环系统(包括心脏、血管、红细胞、白细胞)、泌尿系统(包括肾脏、膀胱等)、淋巴免疫系统(包括T细胞、树突细胞、单核细胞和巨噬细胞)、内分泌系统、生殖系统、大脑神经系统(包括脑组织、神经元、嗅觉、味觉细胞)。。。
公众能够自行认识到,新冠病毒的泛器官、泛组织感染、破坏能力;但普通公众难以知道,难以想象到,新冠病毒这一外在能力背后所蕴含的一组震古烁今的内在能力:新冠病毒的受体结合蛋白(S蛋白)能够结合超过30种人类细胞受体(人类细胞膜蛋白)!
坐拥30种以上人类细胞受体不是新冠病毒非凡受体结合能力的全部。新冠病毒不仅集众多冠状病毒、众多非冠状病毒的受体结合能力于一身,而且兼具细菌分泌物、人体蛋白、人类药剂的受体/蛋白结合能力。比如,新冠病毒S蛋白结合TCR(T Cell Receptor,T细胞受体)的多肽,在序列和空间结构上与葡萄球菌肠毒素B(金黄色葡萄球菌的代谢产物)高度相似;再比如,新冠病毒S蛋白结合NRP1(神经纤毛蛋白-1)受体的Cendr多肽,与NRP1的一种体内天然结合配体--VEGF-A(血管内皮生长因子-A,一种人体内的二聚体糖蛋白),在NRP1的结合结构、结合机制上非常相似;又比如,新冠病毒S蛋白结合GRP78(葡萄糖调节蛋白78)受体的四个多肽区域,与一种肿瘤化疗的药物载体Pep42(Pep42是GRP78的特异性结合配体)在序列上、在空间环状性质上,在物理、化学性质上都具有相似性。
由于新冠病毒能够结合超过30种人类细胞受体--人类细胞膜蛋白,由于这些膜蛋白驻留的细胞分布在各种人体器官、组织中,因此,各个器官、组织中的每种人体细胞的表面,几乎总有一种或多种新冠病毒可结合的膜蛋白受体,进而,几乎每一种人体细胞,都可被新冠病毒经由一种或多种受体结合途径感染。S蛋白极其广泛、惊人的受体结合能力,是新冠病毒具有泛器官、泛组织感染、破坏能力的最关键原因。
新冠病毒30种以上的受体结合能力,是前所未见的,是其它所有冠状病毒,其它所有病毒难以企及、难望颈背的。
如果新冠病毒来自自然、来自动物,那么它是前无古人的超级自然演化天才,它在远离人类的地方,无师自通,通过随机性的、无目的的自然演化,自然而然地演化出了史无前例的超级广泛、超级惊人的人类受体结合能力。它自然演化出了近亲病毒无一具有的20多种人类受体结合能力,它自然演化出了众多非冠状病毒的人类受体结合能力,它还自然演化出了细菌分泌物、人类蛋白、人类药剂的人类受体结合能力、结合结构。这样的自然演化真的自然吗?
如果新冠病毒来自自然,来自动物,那么,刚刚在人群中出现的这种病毒,为什么对人体如此熟悉,如此了如指掌?为什么对结合人体膜蛋白受体,对感染、破坏人体细胞、组织、器官,这种病毒如此轻车熟路、得心应手、游刃有余?
无法解释、无法面对,只能回避、躲闪、拖延、淡化、冷处理、装糊涂、隐瞒、混水摸鱼。你的声音难以得到传播和讨论,甚至得不到反驳。对某些人来说,强权即公理;对某些人来说,阵营、立场、利益决定是非;通常人们愿意相信,一种鲜有呼应、过于孤独的诉说应该是虚构的或臆想的,不会是事实、真相。尽管反面的例子在人类历史上一再发生。
下面将一一介绍新冠病毒S蛋白可结合的人类细胞受体,每一种受体都将给出论文依据。如果某些论文的介绍比较冗长,读者可一目十行或直接跳过它们,论文标题往往已可说明问题。论文细节对笔者和某些读者或许有参考价值。
1、ACE2
ACE2:Angiotensin-Converting Enzyme 2,血管紧张素转换酶2,最早确认的、众所周知的新冠病毒受体。ACE2较广泛地存在于脊椎动物的呼吸、消化、血液、泌尿、生殖、视觉等系统的众多器官、组织内,但在新冠病毒的首要感染部位--呼吸道和肺部,ACE2的表达量(含量)却相当低或仅有一小部分细胞表达,在新冠病毒的另外一些感染部位,如肝脏,脑和血液中,甚至检测不到ACE2表达。
ACE2也是SARS-CoV和HCoV-NL63的主要受体,HCoV-NL63是有人类致病能力的七种已知冠状病毒之一,可引发普通感冒。
对ACE2就不多作展开了。
2、DPP4(CD26)
DPP4:dipeptidyl peptidase IV,二肽基肽酶4,是一种II型(N端在胞内,C端在胞外)单次跨膜蛋白,也是一种丝氨酸蛋白酶。DPP4也叫CD26(cluster of differentiation 26,表面抗原分化簇26,白细胞/T细胞活化抗原26),它还有adenosine deaminase (ADA) complexing protein-2 (腺苷脱氨酶复合蛋白-2)等其它名称。
DPP4在众多人体器官、组织中广泛分布,如下呼吸道(支气管)、肺(特别是肺成纤维细胞)、胃肠道、肝脏、肾脏(近端肾小管)、胰腺、胸腺、前列腺、淋巴结、胎盘、血浆(及其它组织液)、中枢神经系统、受伤皮肤、肌肉等等;DPP4也广泛表达于各种活化的免疫细胞,如CD4(+)和CD8(+)T细胞、B细胞、自然杀伤细胞、树突状细胞和巨噬细胞。
DPP4在血糖控制(是肠降血糖系统的关键调节因子)、细胞迁移、增殖、免疫等多种生理过程中发挥作用;DPP4通过调节细胞因子、趋化因子和肽激素的产生,参与免疫、炎症反应并参与、影响多种疾病的发病机制。其中一个例子是,糖尿病患者溃疡部位组织DPP4 水平升高是创面难以愈合的原因。
DPP4是MERS-CoV(Middle East Respiratory Syndrome Coronavirus,中东呼吸综合症冠状病毒)的主要受体。MERS属于冠状病毒β谱系的C支系,新冠属于冠状病毒β谱系的B支系,虽然同处β谱系,但二者亲缘关系遥远,基因差异巨大,二者全基因组序列一致性仅为53.5%。虽然遗传关系遥远,基因差异巨大,但新冠病毒依然兼容并蓄地“继承”、兼具了非近亲MERS的DPP4受体结合能力。
新冠病毒(SARS-CoV-2)S蛋白有较强的DPP4结合亲和力,DPP4可能是新冠病毒的受体或共受体。
论文依据一:
The MERS-CoV Receptor DPP4 as a Candidate Binding Target of the SARS-CoV-2 Spike
MERS-CoV受体DPP4是SARS-CoV-2刺突的候选结合靶点
https://www.cell.com/iscience/fulltext/S2589-0042(20)30345-X
论文要点如下:
1、软件模拟计算表明,SARS-CoV-2-S(SARS-CoV-2的S蛋白,Spike蛋白)可以较高的结合亲和力结合DPP4,SARS-CoV-2-S与DPP4的结合亲和力略低于MERS-CoV-S与DPP4,及SARS-CoV-2-S、SARS-CoV-S与ACE2的结合亲和力。如下图所示:
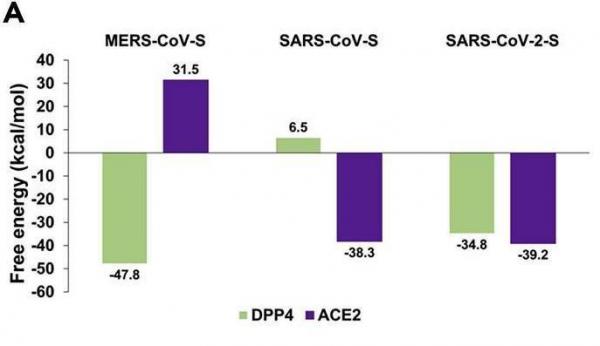
三种病毒S蛋白RBD与两种受体的结合自由能
RBD:Receptor Binding Domain,受体结合域,是S蛋白S1亚基的一个子区域。
结合自由能(binding free energy)大体是两个分子/蛋白结合后的总能量与结合前总能量的差值。自发结合的两个分子/蛋白不需要外部能量(类似磁铁相异的两极),其结合过程释放能量,结合后二者的总能量降低,二者的结合自由能为负。结合自由能的绝对值等于解开结合(解离)时所需的外部能量。结合自由能越小,即负值的绝对值越大,越容易自发结合,结合亲和力越强,结合越稳固,解离所需的能量也越高。在上图中,MERS-CoV-S与DPP4的结合亲和力最强。
2、DPP4结合SARS-CoV-2-S的氨基酸残基,与DPP4结合MERS-CoV-S的氨基酸残基是相同的,即SARS-CoV-2-S、MERS-CoV-S与相同的DPP4残基作用、结合。如下图所示:
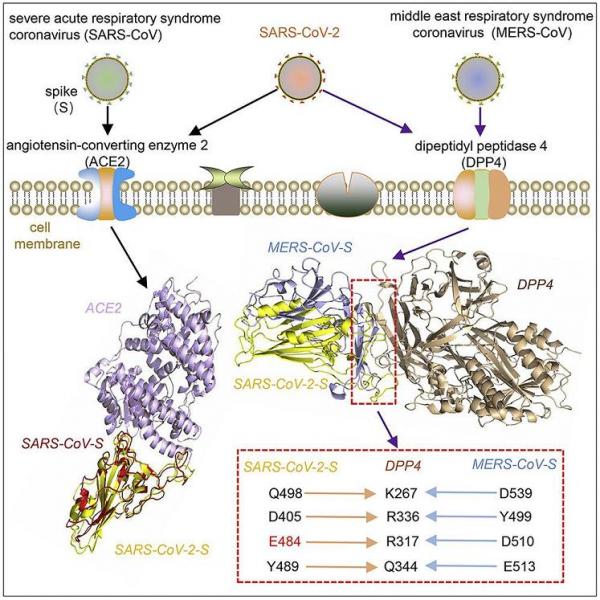
新冠兼具SARS(ACE2)、MERS(DPP4)的受体结合能力;
右下红色虚线框显示,新冠、MERS与4个相同的DPP4氨基酸残基作用、结合。
笔者注:层出不穷的新冠巧合。SARS-CoV-2-S、MERS-CoV-S恰好共用相同的DPP4结合残基,这可能意味着,有人参照MERS-CoV-S与DPP4的作用机制,设计出了可与同一组(4个)DPP4氨基酸作用、结合的另一套氨基酸,并将这套氨基酸应用到了SARS-CoV-2-S的RBD之中。
3、负责与DPP4作用、结合的四个SARS-2(RBD)关键氨基酸(残基)D405、E484、Y489、Q498,其中的二个D405(天冬氨酸)、Y489(酪氨酸)在SARS-CoV中的对应氨基酸与它们相同;另外的两个E484、Q498在SARS-CoV中的对应氨基酸与它们不同。E484(谷氨酸)在SARS-CoV中的对应氨基酸空缺(SARS-CoV氨基酸序列相对SARS-CoV-2氨基酸序列的一个缺失位点),Q498(谷氨酰胺)则在SARS-CoV中对应一个酪氨酸Y位点。如下图所示:

SARS-CoV-2的四个DPP4结合氨基酸在SARS-CoV中的对应氨基酸
笔者注:这意味着,SARS-CoV如果在第一个差异位点突变新增谷氨酸E,并将第二个差异位点的酪氨酸Y突变为谷氨酰胺Q,那么,就能演化出DPP4结合能力;或者,在第一个差异位点插入谷氨酸E,将第二个差异位点的酪氨酸Y替换为谷氨酰胺Q,就可以基于SARS-CoV的氨基酸序列,设计、改造出具有DPP4结合能力的新型冠状病毒。
4、论文指出,虽然SARS-CoV-2的S蛋白具有较强的DPP4结合亲和力,但尚未实验证实DPP4可独立介导SARS-CoV-2对人体细胞的感染,因此,论文的结论是,DDP4可能作为SARS-CoV-2的候选结合靶点或共受体(协同受体)。
论文依据二:
Emerging COVID-19 coronavirus: glycan shield and structure prediction of spike glycoprotein and its interaction with human CD26
新出现的COVID-19冠状病毒:刺突糖蛋白的糖链屏蔽和结构预测及其与人CD26的相互作用
https://www.tandfonline.com/doi/full/10.1080/22221751.2020.1739565
论文指出:COVID-19冠状病毒S蛋白的S1结构域可能与人类CD26(即DPP4)相互作用,而CD26是劫持和毒力的关键免疫调节因子。
注:S蛋白的S1结构域即S蛋白的S1亚基,S1亚基也叫受体结合亚基,RBD是S1亚基的子区域。相应地,S2亚基也叫膜融合亚基,它富含融合肽,可介导病毒包膜与细胞膜、内体膜或溶酶体膜等细胞的膜结构发生膜融合以释放病毒RNA,开启病毒复制。
论文依据三:
Unraveling the Interactions between Human DPP4 Receptor, SARS-CoV-2 Variants, and MERS-CoV, converged for Pulmonary Disorders Integrating through Immunoinformatics and Molecular Dynamics
通过整合免疫信息学和分子动力学,揭示人类DPP4受体、SARS-CoV-2变体和MERS-CoV之间的相互作用,聚焦治疗肺部疾病
https://www.biorxiv.org/content/10.1101/2023.03.06.531252v1
论文指出:SARS-CoV-2的几种变体Delta、δ、α和γ具有比原始毒株更强的DPP4结合能力,增强最显著的是Delta变体,其DPP4结合亲和力非常接近MERS-CoV的DPP4结合亲和力;SARS-CoV-2的S蛋白与DPP4的相互作用影响病毒毒性,DPP4结合能力的增强更容易引发感染合并症。
论文依据四:
Circulating levels of soluble Dipeptidylpeptidase-4 are reduced in human subjects hospitalized for severe COVID-19 infections
因严重COVID-19感染而住院的人类受试者中可溶性二肽基肽酶4的循环水平降低
https://www.nature.com/articles/s41366-020-00689-y
论文指出:COVID-19患者的sDPP-4(soluble DPP4/serum DPP4,可溶形式的DPP4或血清中的DPP4)水平显著降低;DPP-4在COVID-19感染中可能发挥调节作用,肥胖和2型糖尿病可能是导致重症的主要危险因素。
反对意见,这篇论文称不支持DPP4(CD26)是SARS-CoV-2的重要受体。
Does the SARS-CoV-2 Spike Protein Receptor Binding Domain Interact Effectively with the DPP4 (CD26) Receptor? A Molecular Docking Study
SARS-CoV-2刺突蛋白受体结合域是否与DPP4 (CD26) 受体有效相互作用?一个分子对接研究
https://www.mdpi.com/1422-0067/22/13/7001
其它相关论文:
Role of Dipeptidyl Peptidase-4(DPP4) on COVID-19 Physiopathology
二肽基肽酶4(DPP4)在COVID-19病理生理中的作用
https://www.mdpi.com/2227-9059/10/8/2026
DPP-4 Inhibitors as a savior for COVID-19 patients with diabetes
DPP-4抑制剂是有糖尿病的COVID-19患者的救星
https://www.futuremedicine.com/doi/10.2217/fvl-2022-0112
Dipeptidyl peptidase-4 (DPP4) inhibition in COVID-19
COVID-19中的二肽基肽酶4(DPP4)抑制
https://link.springer.com/article/10.1007/s00592-020-01539-z
3、NRP-1
NRP-1/NRP1 :Neuropilin-1,神经纤毛蛋白-1,一种Ⅰ型(C端在胞内,N端在胞外)跨膜蛋白,是最早被发现的NRP家族成员,在人体多种组织(如呼吸道、心脏、血管、淋巴结、淋巴管和神经元等等)的上皮和内皮细胞中大量表达。Nrp-1还在自然调节性T细胞上高表达,是这类T细胞区别于诱导性调节性T细胞的标志。
NRP-1与另一种神经纤毛蛋白NRP-2参与各种生理过程,包括免疫突触形成、免疫应答调节、心脏发育、血管生成、淋巴管生成、神经元发育、神经嵴细胞迁移、调节生长因子信号传导等等。NRP-1和NRP-2与癌症、神经系统疾病及心血管疾病的发病机制有关。
NRP-1也是EBV和HTLV-1的感染受体或细胞进入因子。
EBV:Epstein-Barr virus,爱泼斯坦-巴尔病毒,即人类疱疹病毒第四型,B淋巴瘤和鼻咽癌的致病因;
HTLV-1:Human T-cell lymphotropic virus type-1,人类T细胞嗜淋巴细胞病毒1 型,成人T细胞白血病的病原体。
就SARS-CoV-2而言,NRP-1是ACE2的辅助受体,当与ACE2同时存在于细胞表面时,NRP-1能大幅提升SARS-COV-2的感染能力。
论文依据一:
Neuropilin-1 facilitates SARS-CoV-2 cell entry and infectivity
Neuropilin-1促进SARS-CoV-2细胞进入和感染
https://www.science.org/doi/full/10.1126/science.abd2985
论文要点摘录如下:
1、SARS-CoV-2(假病毒)不能感染仅表达NRP1的人肾HEK-293T细胞(下图未体现这一点),但当NRP1与ACE2及TMPRSS2同时在HEK-293T细胞中表达时,SARS-CoV-2对HEK-293T细胞的感染能力得到大幅提升(HEK-293T细胞自身不表达ACE2和NRP1,所用的是转染了相应蛋白基因的细胞)。
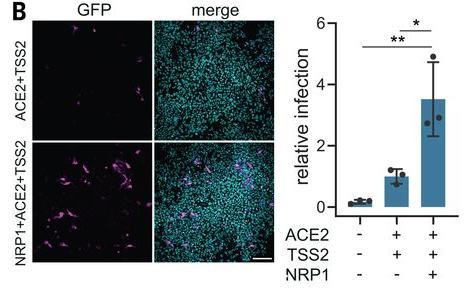
NRP-1显著提升了SARS-CoV-2 对HEK-293T细胞的感染能力
依据论文,该研究所用的SARS-COV-2假病毒是用SARS-CoV-2的S蛋白与lentiviral(慢病毒,逆转录科慢病毒属病毒)骨架嵌合制作的。最常用的慢病毒类型的假病毒骨架(载体)是去毒性HIV(艾滋病病毒)。
HEK293细胞,Human Embryonic Kidney Cells 293,人胚胎肾细胞293,一个衍生自人胚胎肾细胞的细胞系;
HEK293T细胞,在HEK293细胞中加入SV40(Simian vacuolating virus 40,猿猴空泡病毒40)大T抗原基因所得的再衍生细胞系。
TMPRSS2:Transmembrane Serine Protease 2(跨膜丝氨酸蛋白酶2)/TransMembrane PRoteaSe, Serine 2(跨膜蛋白酶丝氨酸2),SARS-CoV-2、SARS-CoV的S蛋白激活因子,ACE2介导的SARS-CoV-2/SARS-CoV感染需要TMPRSS2作为S蛋白激活因子。
2、NRP1还促进了SARS-CoV-2假病毒对人结肠Caco-2细胞的感染,对照结果是,NRP1没有促进VSV-G假病毒对Caco-2细胞的感染,如下图所示:
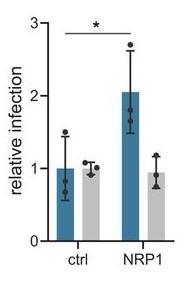
NRP1促进了SARS-CoV-2假病毒对Caco-2细胞的感染,但未影响VSV-G假病毒感染
图中蓝色条柱对应SARS-CoV-2假病毒,灰色条柱对应VSV-G假病毒,ctrl(对照组)使用的是未转染NRP1基因的Caco-2细胞。
Caco-2细胞是一种人类结肠腺癌上皮细胞系细胞,Caco-2细胞自身表达ACE2。
所用VSV-G假病毒是用VSV(vesicular stomatitis virus,水泡性口炎病毒)的受体结合蛋白--G蛋白与慢病毒嵌合制作的。
3、NRP1单克隆抗体mAb3可显著抑制SARS-CoV-2对表达NRP1的HEK-293T细胞(同时转染表达ACE2、TMPRSS2和NRP1)的感染,mAb3并不抑制SARS-COV-2对不表达NRP1的HEK-293T细胞(只转染表达ACE2、TMPRSS2)的感染;
4、对六位Covid-19患者的尸检结果表明,其中五位患者的嗅觉上皮细胞被SARS-CoV-2感染。嗅觉上皮细胞的ACE2表达非常低,但NRP1的表达却很富集。
论文依据二:
Neuropilin-1 is a host factor for SARS-CoV-2 infection
Neuropilin-1是SARS-COV-2感染的宿主因子
https://www.science.org/doi/full/10.1126/science.abd3072
论文指出:
1、(跨膜蛋白)NRP1的b1结构域(NRP1胞外域两个凝结因子域中的一个)直接结合SARS-CoV-2-S的S1亚基的Cendr肽。Cendr肽由SARS-2 S蛋白氨基酸序列的第679~685氨基酸(679NSPRRAR685 ,即679天冬酰胺N-丝氨酸S-脯氨酸P-精氨酸R-精氨酸R-丙胺酸A-精氨酸R)组成,它们恰好是S1亚基的最后七个氨基酸,Cendr肽的后四个氨基酸“RRAR”就是SARS-2的基本furin切割序列。
下面又是一处新冠巧合,这次不是SARS-2与MERS的巧合,而是SARS-2与人体蛋白的结构、功能巧合。
2、在NRP1结合特性、结合结构方面,SARS-CoV-2的Cendr肽与一种人体蛋白VEGF-A非常相似。一方面,二者与几乎完全相同的一组NRP1-b1域氨基酸作用并结合;另一方面,Cendr肽、VEGF-A二者与NRP1-b1作用、结合的区域,在空间结构、空间形态上非常相似、吻合,如下图所示:
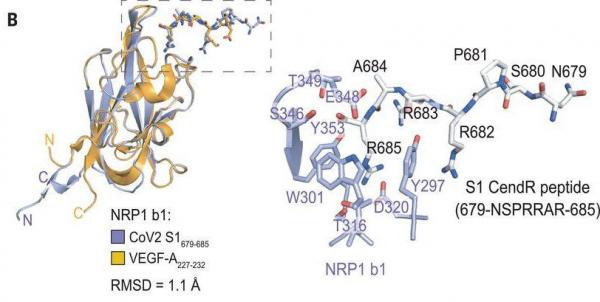
左图:SARS-2的CendR肽(蓝色)与人类的VEGF-A(黄色)方框区域的相似性、吻合性
右图:NRP1的b1域与SARS-2 CendR肽的结合复合物示意图;
3、CendR肽与NRP1 b1域之间的相互作用决定NRP1对SARS-CoV-2感染的促进,突变(替换)CendR肽中的氨基酸残基(R685)或NRP1 b1域的氨基酸残基(T316)都将丧失NRP1对SARS-CoV-2感染的促进作用;
4、NRP1 b1域、b2域的胞外域单克隆抗体mAb#3和mAb#1可抑制SARS-CoV-2对Caco-2细胞和Calu-3细胞(也是一种人肺腺癌细胞系)的感染;
5、选择性NRP1拮抗剂EG00229可抑制SARS-CoV-2对Caco-2细胞的感染;
该论文就摘要介绍到此。思考、探讨一下论文所指出的,SARS-CoV-2的CendR肽与人类蛋白VEGF-A的相似性。
VEGF-A,Vascular Endothelial Growth Factor-A,血管内皮生长因子-A,也叫做血管通透因子(Vascular permeability factor,VPF)或血管调理素(vasculotropin),是一种二聚体糖蛋白,发现于1983年,是发现最早、研究最多、在组织和细胞中含量最丰富的VEGF家族成员(该家族共七个成员)。
VEGF-A的一个重要特性就是它具有NRP1/NRP2的结合能力,特别是,VEGF-A有非常高的NRP1 b1域结合亲和力,是NRP1 b1域的经典内源性(结合)配体(内源指二者都来自机体内)。2012年的如下论文解析了VEGF-A与NRP1 b1高结合强度的内在结构原因,并指出VEGF-A164(小鼠中的VEGF-A)与Nrp1的结合强度是其与Nrp2结合强度的50倍。
Structural Basis for Selective Vascular Endothelial Growth Factor-A (VEGF-A) Binding to Neuropilin-1
与Neuropilin-1结合的选择性血管内皮生长因子-A(VEGF-A)的结构基础
https://www.jbc.org/article/S0021-9258(20)48040-8/fulltext
SARS-2不仅模仿了MERS的DPP4结合能力、结合机制,还模仿了人类蛋白VEGF-A的NRP1-b1结合能力、结合结构。SARS-2的Cendr肽,与人类的VEGF-A蛋白,结合几乎完全相同的NRP1-b1氨基酸,二者与NRP1-b1作用区域的空间结构、空间形态非常相似、吻合。试问,Cendr肽与VEGF-A的相似、相关性,前者对后者NRP1-b1结合能力、结合结构的模仿,是随机、无目的自然演化的偶然结果吗?
新冠病毒的结构、能力巧合与模仿,笔者已经介绍过很多,后继文章中还将出现更多新冠专有的模仿和巧合。
4、MYH9(NMMHC-IIA)
MYH9 :Myosin Heavy Chain 9 ,肌球蛋白重链9,也叫non-muscle myosin heavy chain IIa (NMMHC-IIA或NMHC-IIA),非肌性肌球蛋白重链IIa,是一种六聚体蛋白,由2个重链亚基MHC,2个碱轻链亚基MLC和2个调节轻链亚基MLC-2组成。
MYH9蛋白空间形态示意图
MYH9是一种运动蛋白,参与多种需要收缩力的过程,如胞质分裂,细胞迁移、极化和粘附,细胞形状的维持和信号转导等等。
MYH9在各种人体组织、细胞中广泛表达,在众多组织、细胞中高度表达,包括病毒组织、细胞,特别是各种癌细胞。
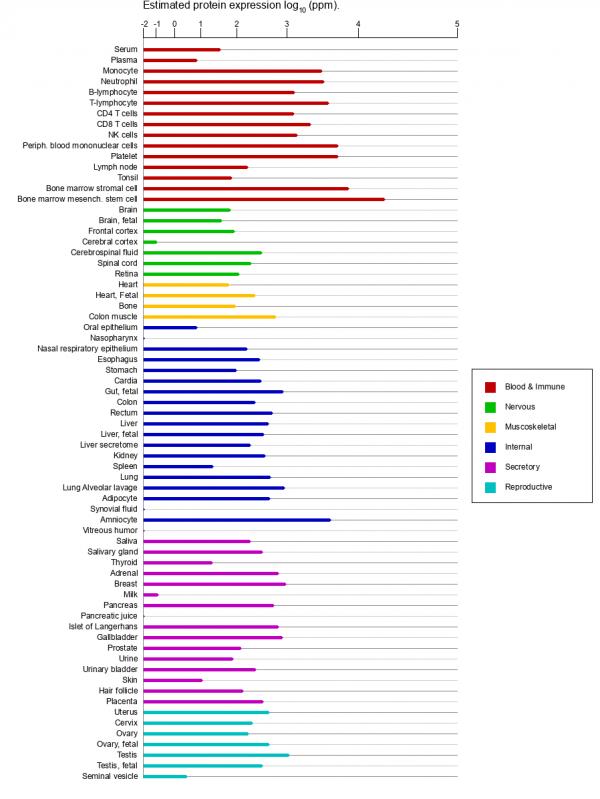
MYH9在正常组织、细胞中的表达情况
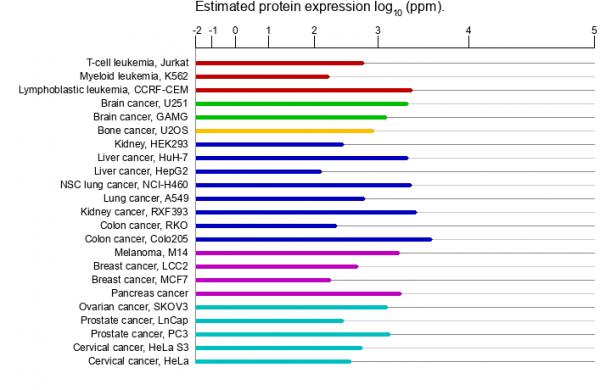
MYH9蛋白在病理组织、细胞中的表达情况
以上三张资料图摘自:
https://www.genecards.org/cgi-bin/carddisp.pl?gene=MYH9
MYH9也是HSV-1(herpes simplex virus-1,单纯疱疹病毒1)、EBV(Epstein-Barr virus,爱泼斯坦-巴尔病毒)、PRRSV(Porcine Reproductive and Respiratory Syndrome Virus,猪繁殖与呼吸综合症病毒)、SARS-CoV、MERS-CoV等病毒的功能受体或感染促进因子。
对SARS-CoV-2而言,MYH9是ACE2的辅助受体或共受体,可显著提升ACE2依赖性感染,对SARS-CoV-2感染ACE2低表达的细胞尤为重要;MYH9对SARS-CoV-2感染的促进作用依赖ACE2,但独立于ACE2感染途径的二个S蛋白激活因子TMPRSS2(跨膜丝氨酸蛋白酶2)和CatB/L(cathepsin B and L,组织蛋白酶B和L)。
论文依据:
Nonmuscle myosin heavy chain IIA facilitates SARS-CoV-2 infection in human pulmonary cells
非肌肉肌球蛋白重链IIA促进人肺细胞中的SARS-CoV-2感染
https://www.pnas.org/doi/10.1073/pnas.2111011118
论文要点如下(略去了少数不易简明理解的要点):
1、NMMHC-IIA(MYH9)是ACE2的辅助受体,是促进SARS-CoV-2感染人肺细胞的关键宿主因子,也是泛冠状病毒感染的关键宿主因子。
2、敲除A549细胞和Calu-3细胞中的MYH9基因显著减少了SARS-CoV-2假病毒对这两种细胞的感染,内源性MYH9(细胞中自然表达的MYH9)的耗竭(敲除)也会降低SARS-CoV和MERS-CoV假病毒的感染。
A549、Calu-3是两种人类肺泡腺癌细胞系。
3、MYH9的过度表达(通过转染增加其表达)增强了SARS-CoV-2假病毒对A549和H1299细胞的感染。
H1299也是一种人类肺腺癌(非小细胞肺癌)细胞系,A549、H1299都是源自2型肺泡细胞的人类肺腺癌细胞系。另说H1299细胞摘取自淋巴结。
4、MYH9主要在细胞膜上与SARS-CoV-2 Spike共定位,通过其C端(碳端、羧基端、COOH端)结构域(C-terminal domain)与Spike的S2亚基以及S1亚基的N端(氮端、氨基端、NH2端)结构域NTD (N-terminal domain)相互作用(与受体发生作用的区域不只是S蛋白的RBD)。
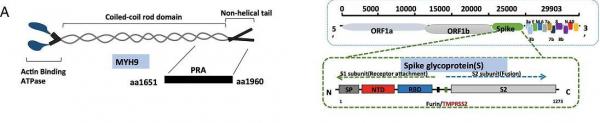
MYH9(左图)、SARS-CoV-2 Spike(右图)构成示意图
5、细胞中PRA(MYH9的C端结构域)的过表达,对多种冠状病毒进入细胞有着广谱的促进作用,PRA的过表达,不同程度地增强了两种α谱系冠状病毒(HCoV-229E和HCoV-NL63)和三种β谱系冠状病毒(SARS-CoV,MERS-CoV,HCoV-HKU1)的S蛋白假病毒对A549细胞的感染。
6、肌球蛋白抑制剂ML-7可有效抑制SARS-CoV-2假病毒对PRA-A549细胞的感染。PRA-A549细胞是转染过表达PRA的A549细胞。
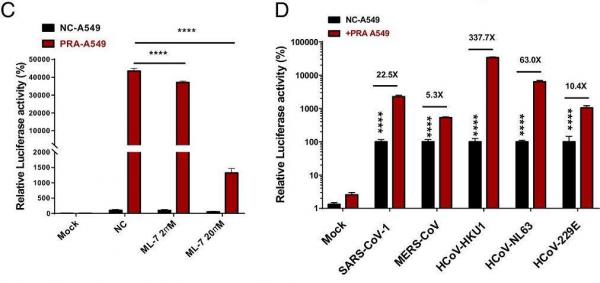
图C:PRA表达增强了SARS-CoV-2假病毒对A549细胞的感染;ML-7抑制了SARS-CoV-2假病毒对PRA-A549细胞的感染;
图D:PRA表达不同程度地增强了五种冠状病毒假病毒对A549细胞的感染。
C、D两图的纵坐标是实验中测得的细胞中荧光素酶的相对活性(Relative Luciferase activity),实验前荧光素酶基因被嵌入到病毒S蛋白中,其数值指示被感染的细胞的相对数量。
7、TMPRSS2(跨膜蛋白酶丝氨酸2)抑制剂camostat mesylate(甲磺酸卡莫司他)和CatB/L(组织蛋白酶B和L)抑制剂E-64d不影响SARS-CoV-2假病毒对PRA-A549细胞的感染;但这两种抑制剂强烈抑制SARS-CoV-2假病毒、SARS-CoV假病毒对Caco-2细胞的感染,并减少了SARS-CoV-2假病毒对野生型A549细胞的感染。即,当细胞不表达PRA或MYH9时,这两种抑制剂可抑制SARS-CoV-2的感染;但当细胞表达PRA或MYH9时,它们不能抑制SARS-CoV-2的感染。这意味着MYH9对SARS-CoV-2感染的促进独立于TMPRSS2和CatB/L。
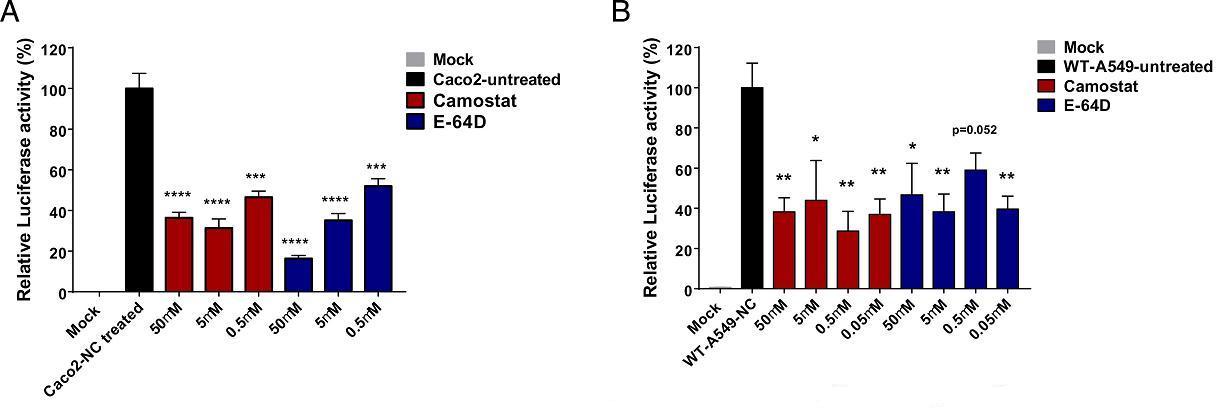
图A:camostat、E-64d抑制SARS-CoV-2假病毒对Caco-2细胞的感染;
图B:camostat、E-64d抑制SARS-CoV-2假病毒对A549细胞的感染。
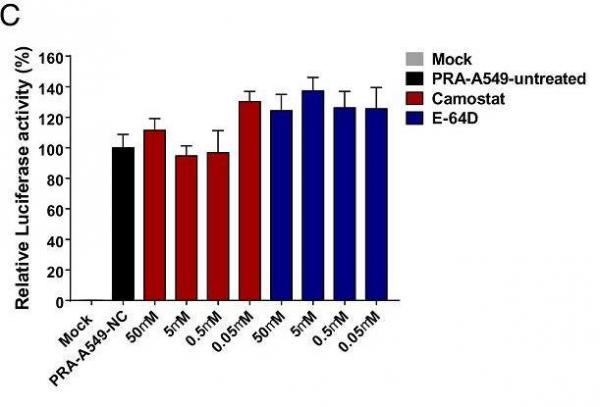
图C:camostat、E-64d不影响SARS-CoV-2假病毒对PRA-A549 细胞的感染
8、内体抑制剂Chloq(氯喹)、NH4Cl(氯化铵)、Baf-A1(巴弗洛霉素-A1)显著抑制SARS-CoV-2假病毒对PRA-A549细胞的感染,它们的抑制作用在较低浓度时已非常强烈,三者在100nM 浓度时就可近乎完全消除感染。
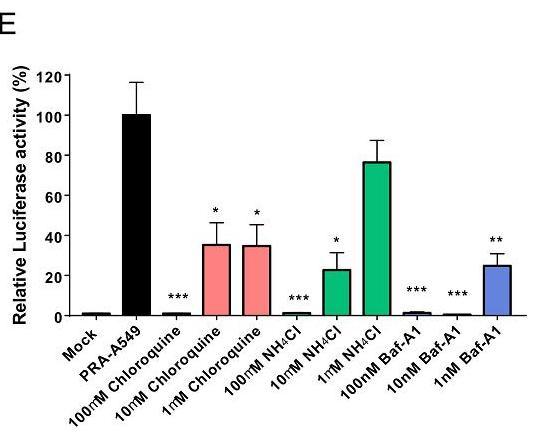
图E:Chloq、NH4Cl、Baf-A1、强烈抑制了SARS-CoV-2假病毒对PRA-A549 细胞的感染
1nM(纳摩尔每升)为10的−9次方mol/dm3(摩尔每升),100nM=0.1μM。
9、以上几组实验表明,MYH9对SARS-CoV-2感染的促进作用与内吞过程有关,但绕过了CatB/L在内吞中的作用(CatB/L在内体、溶酶体或其它转运体中水解激活S蛋白,促成膜融合、释放RNA),同时不依赖TMPRSS2对S蛋白的激活作用。
10、如果耗尽(敲除)PRA-A549细胞中的ACE2,则SARS-CoV-2假病毒的感染几乎被消除,ACE2的过表达则增强了SARS-CoV-2假病毒对A549细胞的感染。
这表明MYH9可能无法充当SARS-CoV-2的独立受体,MYH9对SARS-CoV-2感染的促进依赖于ACE2的存在(至少需要较低表达的ACE2)。
另一方面,MYH9的耗竭(敲除)也几乎消除了SARS-CoV-2假病毒对A549细胞的感染。
如下图所示,
a) SARS-CoV-2假病毒几乎无法感染各种敲除(KO,Knocking Out)了MYH9或ACE2基因的A549细胞;
b) SARS-CoV-2假病毒能感染WT-A549细胞(Wild-Type A549细胞,野生型A549细胞,未作转染或转基因处理的天然A549细胞,该细胞自身表达ACE2和MYH9);
c) SARS-CoV-2假病毒对转染的过表达ACE2的A549-ACE2细胞有更强的感染力。

SARS-CoV-2假病毒不能有效感染敲除了MYH9或ACE2的A549细胞
11、敲除MYH9基因也减弱了SARS-CoV-2真病毒对ACE2-A549细胞的感染。如下图所示:
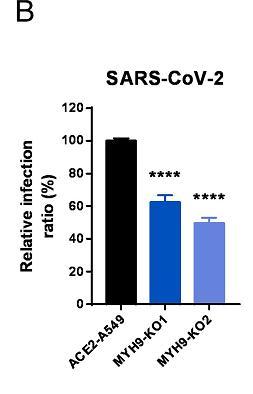
MYH9-KO1、MYH9-KO2是两组敲除了MYH9蛋白基因的ACE2-A549细胞,不清楚二者的区别。
12、敲除MYH9基因也减弱了SARS-CoV-2真病毒对ACE2-H1299细胞的感染。如下图所示:
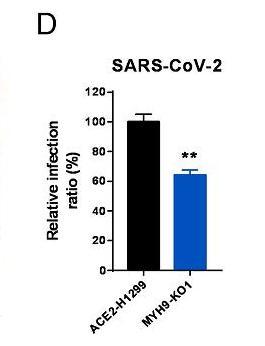
图中的MYH9-KO1是敲除(KnockOut)了MYH9蛋白基因的ACE2-H1299细胞。
13、敲除MYH9基因极大抑制了SARS-CoV-2真病毒对Calu3细胞的感染。如下图所示:
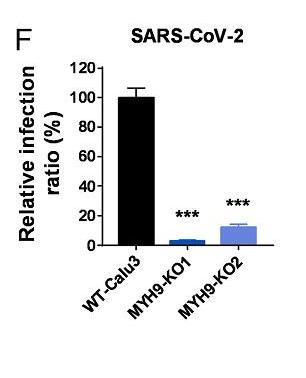
Calu3/Calu-3也是一种人肺腺癌细胞系。
14、论文总结说,MYH9在SARS-CoV-2感染过程中作为ACE2的共受体而发挥重要作用,它以ACE2依赖性方式通过内吞作用介导SARS-CoV-2进入宿主细胞,MYH9-PRA对SARS-CoV-2感染的促进与TMPRSS2和CatB/L无关。
该论文有中文报道:
徐建青_张晓燕团队《PNAS》报道MYH9是SARS-CoV-2感染的共受体——增强ACE2依赖性内吞作用以促进感染
https://ibs.fudan.edu.cn/76/26/c24338a423462/page.htm
(未完待续)
|
