(二)拉尔夫·巴里克与新冠的furin酶切位点
上
接续:拉尔夫·巴里克与新冠病毒的不解之缘(一)
I 新冠病毒具有致病能力强大的furin酶切位点
冠状病毒的S蛋白(spike蛋白,刺突蛋白)由两个部分组成。位于前端,朝向外部的是S1蛋白,与S1蛋白相连并嵌入病毒包膜的是S2蛋白。S1蛋白负责与嵌在宿主细胞膜上的受体蛋白(如ACE2--血管紧张素转换酶2,TMPRSS2--跨膜丝氨酸蛋白酶2,CD4--表面抗原分化簇4糖蛋白等等)结合,也称为受体结合亚基(attachment
subunit);S2蛋白含有融合肽,可介导病毒包膜与宿主细胞膜融合,也称为膜融合亚基(fusion subunit)。
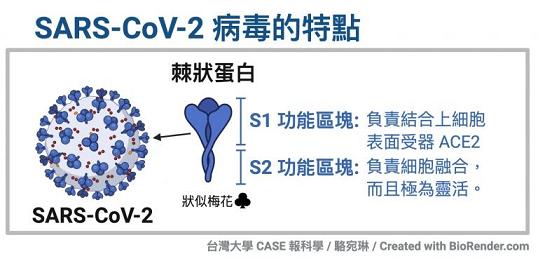
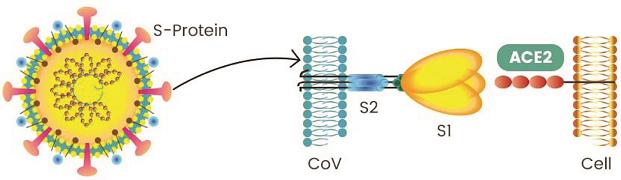
新冠病毒具有furin(弗林)酶切位点,新冠的furin酶切位点恰好位于刺突蛋白受体结合亚基S1、膜融合亚基S2的交界处。
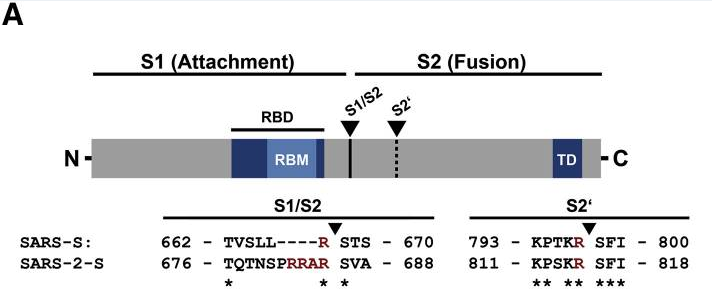
新冠病毒具有多项其近亲病毒无一具有的特殊结构,furin酶切位点是其中之一。如上图所示,相比近亲病毒SARS,新冠病毒(图中的SARS-2)S蛋白在S1、S2亚基交界处,多出了四个氨基酸(残基)“PRRA”(脯氨酸-精氨酸-精氨酸-丙氨酸),其中后三个氨基酸“RRA”,与其后的精氨酸
“R”形成了“RRAR”(精氨酸-精氨酸-丙氨酸-精氨酸)四氨基酸组合,这一组合符合furin蛋白酶的识别模式“RXXR”(X是通配符)。S1/S2位置处(即S1、S2交界处)的“RRAR”四氨基酸组合就是新冠病毒的furin酶切位点。
人体内的furin蛋白酶在识别“RRAR”位点后,将从最后一个精氨酸“R”处对刺突蛋白进行切割,使S1、S2亚基分离。这是一个furin蛋白酶促成的水解、裂解过程。
注:“RRAR”组合末尾的精氨酸“R”是新冠S蛋白的第685个氨基酸(残基),也是S1亚基的最后一个氨基酸(残基)。
S1、S2亚基交界处的furin酶切位点,对新冠病毒感染、致病、传播能力的贡献极为巨大。
2020年2月4日,南开大学高山、阮吉寿等学者在中国预印本论文平台ChinaXiv发表了一篇题为“武汉2019冠状病毒S蛋白可能存在Furin蛋白酶切位点”的论文,
http://chinaxiv.org/abs/202002.00004
http://swxxx.alljournals.cn/html/2020/2/20200205.html
该论文率先报告了新冠病毒中的furin酶切位点,论文指出:
1、 2019-nCoV的S蛋白可能存在Furin蛋白酶切位点,这一结构是大部分Beta冠状病毒(新冠和SARS同处冠状病毒的β谱系,即第二谱系,冠状病毒共四个谱系),特别是SARS和类SARS(SARS-like)冠状病毒所不具有的。
2、由于具有Furin酶切位点,因此,新冠的感染机制将有别于SARS等大部分Beta冠状病毒,而与鼠肝炎冠状病毒、HIV、埃博拉病毒和一些禽流感病毒的感染机制更相似(后四类病毒都有furin酶切位点)。
3、furin酶切位点将显著增强新冠病毒的细胞侵染能力和传播能力。援引一篇2005年论文中(蛋白酶介导对感染效率影响)的有关数据,2019-nCoV的细胞侵染效率将是SARS-CoV的100~1000倍。
https://www.pnas.org/content/102/35/12543
为什么furin酶切位点如此强大,能将新冠病毒的侵染效率提高100~1000倍之多?
在感染宿主细胞时,新冠病毒需要先利用刺突蛋白前端的S1亚基结合ACE2等嵌在宿主细胞膜上的受体蛋白,将自己锚定(绑定)到细胞膜上;接着,病毒将暴露出S1、S2亚基的连接处,使这一位置处的“RRAR”酶切位点被组织环境中furin蛋白酶识别。在furin蛋白酶的作用下,刺突蛋白将被水解裂解,S1、S2亚基将被割裂、分离。
S1亚基从刺突蛋白上分离、脱落后,膜融合亚基S2将得以暴露出来,直接与细胞膜接触,继而介导病毒包膜与宿主细胞膜发生膜融合。二膜融合之后,包膜内的病毒RNA将进入到宿主细胞中。得到脱壳释放的病毒RNA将在细胞内立即开始RNA自我转录、复制,合成各种结构蛋白、非结构蛋白、辅助蛋白,并以复制、合成的RNA及结构蛋白组装出新的新冠病毒。
相比之下,S1/S2处没有furin酶切位点的SARS病毒(SARS-CoV)的S1、S2亚基在受体结合后不会被切割、分离(除非在有胰蛋白酶存在的小肠)。在通常的肺部感染中,SARS的S2亚基无法暴露到刺突蛋白前端,没有机会与细胞膜直接接触,不能介导病毒包膜与宿主细胞膜发生“膜融合”。在完成受体结合后,SARS病毒将以一种叫做“胞吞”或“内吞”的方式“囫囵吞枣”、“连皮带瓤”地整个被“吞”入宿主细胞中,并在部分细胞膜的包裹下形成内吞体。内吞后,SARS病毒不能立即开始病毒复制,原因是,虽然已进入细胞,但RNA还困在病毒包膜内,整个病毒还裹在内吞体中,处于被“关小号”的“禁闭”状态。SARS病毒还需要继续等待,等待病毒包膜与内吞体膜发生融合。细胞内的膜融合完成后,病毒RNA才能破茧而出,获得充分自由,直到这时,它才能利用细胞资源开始病毒复制过程。
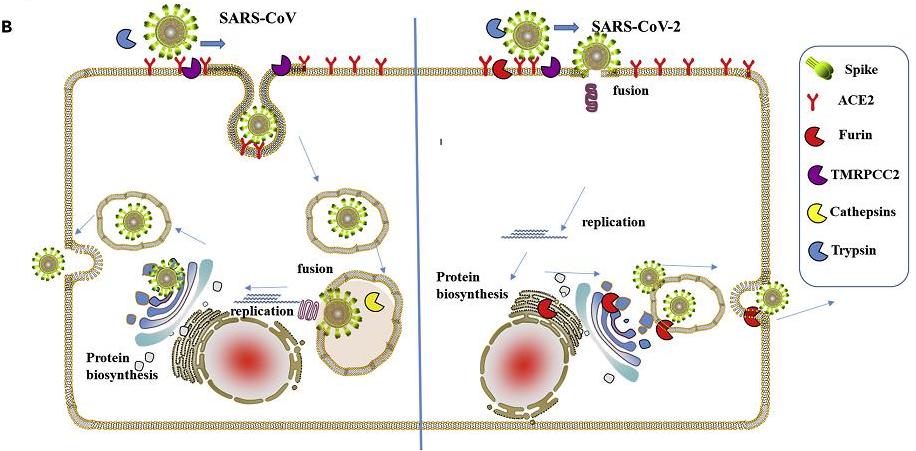
新冠与SARS细胞感染生命周期(侵入、脱壳、复制、扩散)对照图
也就是说,新冠病毒细胞感染周期中的侵入、脱壳(释放RNA)两个步骤是同时完成的,而SAR病毒是分步完成的:先整体侵入,而后在细胞内脱壳。相比新冠病毒,SARS病毒的复制过程显著迟缓,其复制出新病毒继续扩散感染的效率明显低下。这就是新冠病毒复制、侵染效率大大高于SARS病毒的原因所在,这一巨大优势正是S1/S2处的furin酶切位点赋予的。
furin酶切位点的强大能力,不仅仅体现在大幅提高感染、复制、扩散效率上。
有furin酶切位点的病毒都相当牛B,其中最著名的是两种非冠状病毒:艾滋病病毒HIV-1、埃博拉病毒(Ebolavirus),furin酶切位点自然也为这两种病毒的强大感染效率和致病能力作出了突出贡献。HIV-1、埃博拉病毒还有一个共同点:它们都具备破坏人体免疫系统的特殊能力。二者的这一能力,也与furin酶切位点有关。简单机理是,当与人体免疫细胞,如T淋巴细胞接触时,它们能够借助高效的膜融合,感染、侵入T细胞。与T细胞的“膜融合”之所以能够发生,当然是拜furin酶切位点所赐。
人体免疫细胞--淋巴细胞计数(明显)减少是WHO和众多国家公认的新冠感染临床诊疗特征(尤其适用于重症、危重症患者)。众多研究表明,淋巴细胞的减少程度,与新冠感染的危重程度存在高度一致性。为什么新冠感染会造成淋巴细胞减少?因为新冠病毒也具备一定程度的免疫破坏能力,新冠可能同时具有三种不同的免疫破坏机制、途径,其中两种与其furin酶切位点有关。
2020年4月7日,(前?)纽约血液中心研究员姜世勃和上海复旦大学的一个研究小组在《Nature》子刊《cellular & molecular immunology》(《细胞分子免疫学》)上合作发表了如下论文:
SARS-CoV-2 infects T lymphocytes through its spike protein-mediated membrane fusion
(新冠病毒通过其刺突蛋白介导的膜融合感染T淋巴细胞)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7136698/
论文指出:
1、新冠病毒有与艾滋病病毒类似的免疫破坏能力,它能够攻击、破坏人体主要免疫细胞-T淋巴细胞。新冠可能是通过受体依赖性的,S蛋白(刺突蛋白)介导的膜融合感染T淋巴细胞的。
2、新冠病毒的免疫破坏能力与艾滋病病毒(HIV-1)不完全相同(比后者弱):HIV-1能感染T细胞并在T细胞内复制、倍增;新冠只能感染T细胞,但不能在T细胞内复制,它将与被感染的T细胞一同降解、消亡(同归于尽)。
新冠病毒还具备由刺突蛋白的其它特殊结构赋予的另一种免疫破坏机制、途径。
2020年1月31日,印度理工学院、德里大学的普拉丹(Pradhan)教授,昆杜(Bishwajit Kundu)教授等学者在生物预印本平台BioRxiv发表了如下广为人知的论文:
Uncanny similarity of unique inserts in the 2019-nCoV spike protein to HIV-1 gp120 and Gag
(2019-nCoV刺突蛋白中的独特插入片断与HIV-1 gp120和Gag的惊人相似性)
https://www.biorxiv.org/content/10.1101/2020.01.30.927871v1.full
论文指出:
1、2019-nCoV
刺突糖蛋白(S蛋白)中有4个插入片段(氨基酸序列位置:404—409,462—467,136—150,366—384,皆位于S1亚基内),这4个插入片段中的前三个片断与HIV-1(艾滋病病毒)的gp120蛋白(包膜蛋白),第四个片断与HIV-1的Gag蛋白(衣壳结构蛋白)相同或非常相似;
2、上述插入片断在自然界中不太可能偶然发生,因为在SARS等其它冠状病毒的S蛋白中,都没有发现上述插入片段,病毒不太可能在短时间内自然地获得这种非常独特的插入片段;
3、gp120蛋白可帮助HIV-1与人类受体CD4(表面抗原分化簇4糖蛋白)结合。CD4糖蛋白通常附着在某些T淋巴细胞的表面,其所附着的T淋巴细胞被称为CD4+T淋巴细胞,是人体免疫系统的重要细胞。HIV-1可利用CD4受体感染T淋巴细胞,破坏人体免疫系统。Gag蛋白也能帮助HIV-1感染某些宿主细胞。
4、在S蛋白中插入gp120蛋白与Gag蛋白后,2019-nCoV将可能获得与HIV-1类似的能力:感染、杀死CD4+T淋巴细胞,破坏人体免疫系统。
论文一经发表,立即招致如潮批判,反驳者声称:“这些插入序列能与相当多物种的序列匹配上,其中大部分甚至都不是病毒。”。这样的反驳毫无意义。上述序列片断在多物种、非病毒中多次出现,根本不能说明,它们出现在新冠病毒中是正常的。问题的关键是,这些片断也应该出现在新冠病毒的近亲病毒中。然而,如论文所指出的:“在SARS等其它冠状病毒的S蛋白中,都没有发现上述插入片段!”没有人反驳这一事实,批判者们无法解释,为什么在其它冠状病毒的S蛋白中,都没有发现上述片段,而偏偏在新冠病毒中,发现了这些片断。
试问,这些基因片断,是怎么来到新冠病毒中的?这些其它冠状病毒S蛋白都不存在的片断,新冠病毒从哪里能够继承得到?其它冠状病毒都未能自然演化出与HIV相同或相似的片断,为什么偏偏新冠病毒独一无二地做到了?
在明处的舆论批判和暗处的强大压力下,这篇今天看来非常客观、理性,一针见血的论文,一度撤稿。
前面提到的姜世勃和复旦大学的论文也遭遇了相似的命运,他们的论文同样涉及了新冠的免疫破坏能力,及与艾滋病病毒的相关性。2020年6月初,他们在《cellular
& molecular immunology》主编的“调查”压力下,对论文进行了大幅修改,新版本中已经看不到与艾滋病病毒有关的内容了。
注:论文早期版本的介绍可参阅如下报道:
亚洲日报:新冠病毒似艾滋 可攻击人体主要免疫细胞
https://www.yazhouribao.com/view/20200413082809536
一个月后的7月10日,他们最终撤回了自己的论文。《cellular & molecular immunology》上的撤回理由非常牵强,无法令人信服,他们应该是在某种压力之下被迫撤回论文的,真正的撤回原因难以对外明言。
https://www.nature.com/articles/s41423-020-0424-9
什么力量在操纵科学期刊、学术平台?什么力量在选择性地暗中控制、左右新冠溯源研究成果的传播?什么力量在压制科学讨论、辩论,阻挠真相的揭晓?
furin蛋白酶在人体器官、组织中广泛存在,其分布的广度、丰度甚至超过了新冠病毒使用的主要受体ACE2,因此,furin酶切位点极大地增强、加剧了新冠病毒的泛器官、泛组织感染、侵害能力。这是furin酶切位点强大能力的第三个体现。
furin酶切位点不但能促使病毒包膜与宿主细胞膜发生膜融合,它还能诱导被感染细胞发生连续的细胞-细胞间膜融合,形成称为Syncytia(合胞体)的多核扩大细胞。研究表明,这一细胞-细胞融合机制能有效提高病毒在组织中的感染、扩散效率;新冠还可通过这一细胞-细胞融合机制内化、杀死多种淋巴细胞(另一种与furin酶切位点有关的免疫破坏机制)。这是furin酶切位点强大能力的第四个体现。
综上所述,S1/S2位置处的furin酶切位点对新冠病毒感染、致病、传播能力的巨大贡献可概括为以下三个方面:
1、极大地提高了新冠病毒的侵染效率、复制效率,体内扩散能力、体外传播能力;
2、为新冠病毒提供了两重杀死免疫细胞,破坏免疫系统的机制、途径;
3、极大地增强、加剧了新冠病毒的泛器官、泛组织感染、侵害能力。
II 新冠的furin酶切位点是人为设计、插入的
为什么新冠病毒的近亲病毒都没有furin酶切位点?为什么在furin酶切位点这一结构上,新冠病毒与它的近亲病毒无一相像,反而和艾滋病病毒(逆转录科慢病毒属病毒)、埃博拉病毒(丝状病毒科病毒)、高致病性禽流感病毒(正黏病毒科病毒)这些八杆子打不着的病毒一致?合理的解释是:有人借鉴这些特殊病毒的强大致病能力及相应结构,在新冠病毒中设计、引入了furin酶切位点。
注:艾滋病病毒gp160蛋白中的furin酶切位点是“REKR”;埃博拉病毒GP蛋白中的furin酶切位点是“RKIR”;如前所述,新冠病毒Spike蛋白中的furin酶切位点是“RRAR”;多种禽流感病毒具有不同的furin酶切位点氨基酸组合。
为什么新冠的近亲病毒,为什么除新冠之外的其它冠状病毒S蛋白中都没有gp120蛋白和Gag蛋白?为什么唯独新冠病毒与毫无亲缘关系的艾滋病病毒共有gp120蛋白和Gag蛋白?合理的解释是:有人借鉴艾滋病病毒的免疫破坏能力及相关结构,在新冠病毒中设计、引入了gp120蛋白和Gag蛋白。
“权威机构”、“权威人士”们要么在撒谎,要么在搅浑水,要么在和稀泥,要么在装糊涂。但这不妨碍我们独立思考、独立判断,明确得出如下结论:
新冠病毒S1/S2位置处的furin酶切位点不可能是自然演化产生的,它肯定是人为设计的。
理由如下:
1、如果新冠的furin酶切位点是自然演化产生的,它应该演化自同宗的近亲病毒。至少应该存在一个近亲病毒,即使它没有完全相同的furin酶切位点,也应该具有相近的结构。然而,新冠病毒的近亲病毒无一在S1/S2处存在furin酶切位点,无一在该位置处存在与“RRAR”相近(>50%的相似度)的四氨基酸组合,根本无法找到该结构的进化来源。
具体而言,
a) 冠状病毒共有四个谱系,新冠病毒位于第二谱系的第二支系,即β谱系的B支系。β谱系B支系在S1/S2处具有furin酶切位点的冠状病毒,只有一种,就是新冠病毒。
b) 与新冠病毒刺突蛋白序列同源性(一致性、相似度)大于40%的冠状病毒,无一在S1/S2处具有furin酶切位点。
下图是新冠病毒(Wuhan-Hu-1毒株)与进化树中亲缘关系较近的其它冠状病毒在S1/S2附近氨基酸序列的对照图。新冠病毒在S1/S2处相比其它病毒多出的四个氨基酸“PRRA”在图中极为突兀(图中其它病毒在S1/S2处都空缺这四个氨基酸),这四个氨基酸人为插入的迹象非常明显。
注:图中的FCS即furin酶切位点(Furin Cleavage Site)
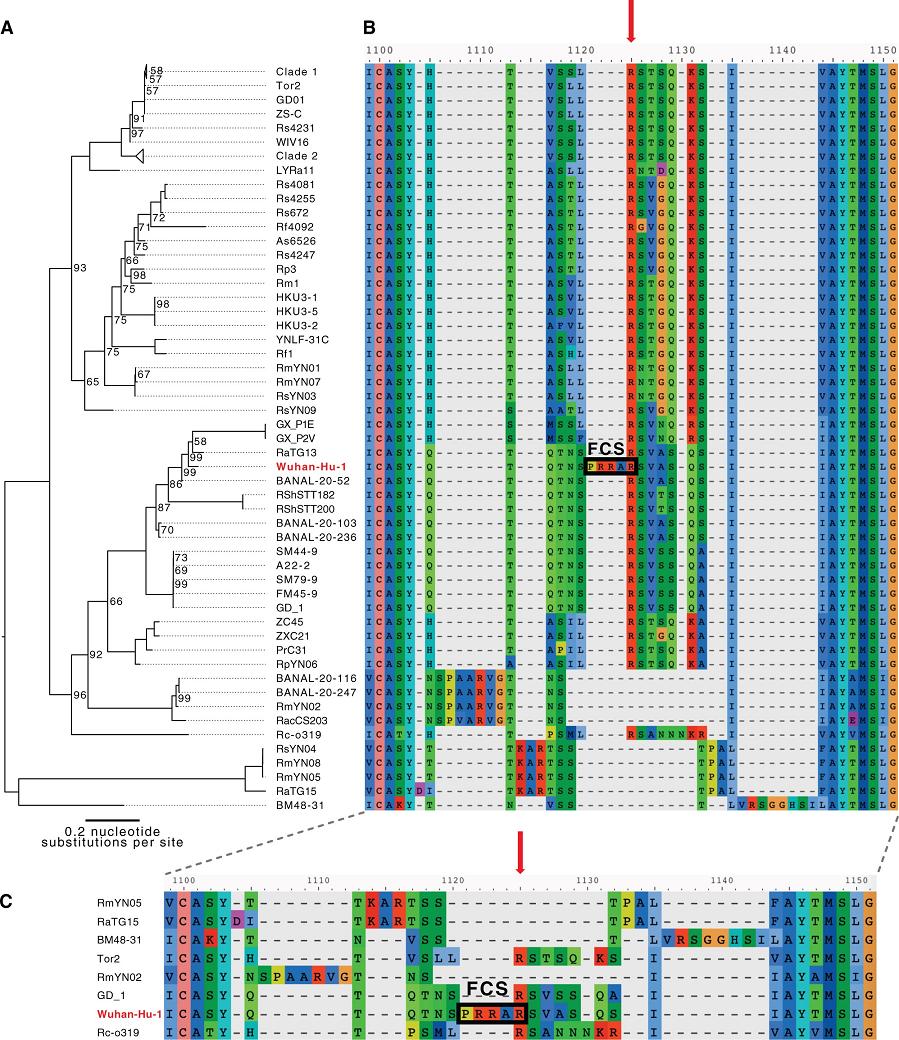
c) 与新冠病毒序列同源度最高的是蝙蝠冠状病毒,但β谱系中的蝙蝠冠状病毒无一具有furin酶切位点;而且,β谱系中的蝙蝠冠状病毒亦如上图所示,几乎无一在S1/S2处有“增生”氨基酸,唯一在S1/S2处有“增生”氨基酸的蝙蝠冠状病毒RmYN02的可靠性是有疑问的。RmYN02在S1/S2处的“增生”氨基酸为“P-AA”,新冠为“PRRA”。
d) 与新冠病毒受体结合域同源度最高的马来亚穿山甲冠状病毒也没有上述furin酶切位点。
试问,新冠病毒从何处遗传、继承S1/S2处的furin酶切位点?为什么新冠病毒的所有近亲无一自然演化出S1/S2处的furin酶切位点,偏偏新冠病毒做到了?
a)、b)两点依据摘自华中科技大学同济药学院李华教授、张勇慧教授等领导的团队2020年10月5日在Cell子刊iScience上发表的如下重磅论文:
Furin A Potential Therapeutic Target for COVID-19(Furin,COVID-19的潜在治疗靶点)
https://www.cell.com/iscience/fulltext/S2589-0042(20)30834-8?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS2589004220308348%3Fshowall%3Dtrue
2、新冠病毒的“RRAR”furin酶切组合在β谱系冠状病毒中是独一无二的,其它β谱系冠状病毒,无一具有“RRAR”四氨基酸组合(在α谱系的猫冠状病毒中发现过“RRAR”组合)。
试问,新冠病毒从何处遗传、继承了“RRAR”酶切组合?为什么其它β谱系冠状病毒无一自然演化出这一酶切组合,唯独新冠病毒做到了?
++++++2022年1月13日更正++++++
此点说法有误。β谱系A支系两种毒性最强的小鼠肝炎病毒MHV-JHM、MHV-3在S1/S2处都含有“RRAR”furin酶切标志。详情参见下文:
新冠furin酶切位点实验室探源,病毒学界的集体捂瞒
++++++更正部分结束++++++
3、由第1点中的相关内容及附图可知,冠状病毒在S1/S2处的基因是高度保守的,不易发生突变。冠状病毒有约3万个核苷酸(碱基对)。短期内,冠状病毒恰恰在3万个核苷酸中高度保守的S1/S2位点自然演化出furin酶切位点的可能性极其微小。经估算,即使忽略S1/S2处的高度保守性,一百年内,新冠的近亲病毒在S1/S2处自然变异出furin酶切位点“RRAR”(对应12个特定核苷酸碱基对)的几率,也要小于10的负10次方!详见下文:
估算舟山蝙蝠病毒一千年内进化出酶切位点的几率
4、新冠furin酶切位点四氨基酸组合“RRAR”中的双精氨酸“RR”是用双CGG密码子(CGGCGG)表达的(精氨酸有6种密码子表达方式,CGG是其中之一)。CGG密码子是冠状病毒中的罕见密码子;双CGG密码子应该在自然来源的各种病毒包括冠状病毒中从未发现或报道过,与双CGG密码子最接近的是一种猫冠状病毒中的CGG-CGA
。另外,双CGG密码子有时在基因编辑中用来标志人工插入片断。
试问,新冠病毒从何处遗传、继承了双CGG密码子?为什么其它冠状病毒、非冠状病毒无一自然演化出双CGG密码子,而偏偏又是新冠病毒独一无二地做到了?是什么力量让新冠病毒总是能“人”所不能?
5、有迹象表明,新冠病毒独有的“RRAR”酶切位点是反复模拟、反复实验精心遴选出来的非常优异的furin酶切位点。前述华中科技大学同济药学院的iScience论文指出:新冠独特的“RRAR”基序是一个非常高效的furin酶切组合,它很容易被furin蛋白酶识别和水解,相比经典的furin酶切位点“RVRR”,“RRAR”在furin蛋白酶作用下的水解、裂解效率是“RVRR”的2倍。
注:“RVRR”是土耳其发现的一种H7N1高致病性禽流感病毒毒株的furin酶切组合。
一穷二白的新冠祖先,不仅在S1/S2这一特殊位置处自然演化出了所有近亲都不具备的致病能力极为强大的furin酶切位点,而且,不演化则已,一演化就演化出了一个比通常的furin酶切组合高效一倍的卓尔不群的furin酶切组合。这是何等牛B的自然演化,何等超自然的自然演化,何等野心勃勃、随心所欲而又无所不能的自然演化!新冠祖先和顶级病毒学家有什么分别?!
6、科学家能不能在(冠状)病毒中人为设计、插入furin酶切位点?太能了!漫无目的地在S1、S2交界处精准地自然演化出furin酶切位点极难,但有目的地人为设计、插入“RRAR”则极为简单、容易,这一定程度上是一个设计、编辑基因序列的文本工作(设计好基因序列之后,用反向遗传平台基于基因序列合成病毒就可以了)。事实上,在(冠状)病毒中插入furin酶切位点的实验、研究,美国科学家早在十多年前就做过了,而且先后做过很多次。
在(冠状)病毒中插入furin酶切位点的具体实验、研究例证将在下篇文章中给出。
(未完待续)
|
