中
接续:谁设计、制造了新冠病毒(二 上)
对前文的回顾、总结与补充
I、新冠病毒S蛋白(刺突蛋白)S1/S2处(S1/S2亚基交界处)四个(相对于其近亲病毒)独特的氨基酸插入“PRRA”(脯氨酸-精氨酸-精氨酸-丙氨酸)与其后的精氨酸
“R”(它是S1亚基的最后一个氨基酸)形成了了“PRRAR”组合,其中,后四个氨基酸“RRAR”(精氨酸-精氨酸-丙氨酸-精氨酸)就构成了新冠病毒S1/S2处的furin酶切位点。
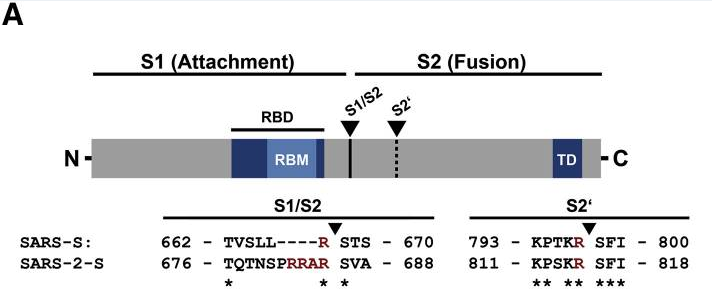
新冠病毒S1/S2处的“PRRA”插入及“RRAR”furin酶切位点
furin酶切位点指蛋白或多肽链中符合“RXXR”模式(四氨基酸组合的首尾氨基酸都是精氨酸R)的氨基酸组合位点,furin蛋白酶能够识别这一组合模式,并从最后一个R处对蛋白或多肽链进行切割。furin蛋白酶在人体及脊椎动物各器官、组织中广泛存在,它分布的广泛性和均衡性超过了新冠病毒使用的主要受体ACE2。
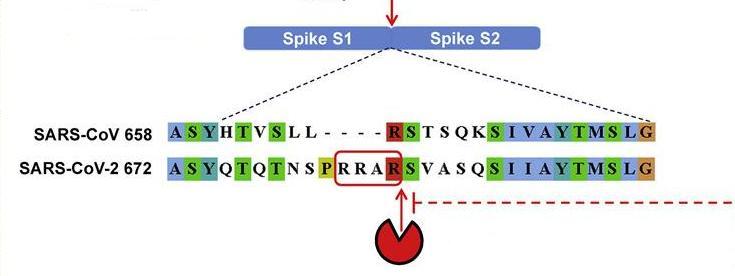
furin蛋白酶的水解切割位置
完成受体结合后,新冠病毒S蛋白在细胞膜外表被furin
蛋白酶水解切割,形成分离的S1亚基(受体结合亚基)、S2亚基(膜融合亚基)两个部分。S1亚基切割脱落后,S2亚基得以暴露、接触细胞膜,它的膜融合能力被激活,将介导病毒包膜与细胞膜发生膜融合。新冠病毒的RNA将在二膜融合后立即得以向细胞内释放,病毒复制将迅速开始。为释放病毒包膜内的RNA(RNA脱壳),冠状病毒的病毒包膜必须在完成受体结合后与细胞膜、内体(囊泡)膜或溶酶体膜之一发生膜融合,后二者发生在内吞过程之后。不经内吞,在细胞表面与细胞膜直接融合,是最高效的脱壳、感染方式。
II、S1/S2处的“RRAR”furin酶切位点在新冠病毒致病(包括感染、致病、体内扩散、体外传播)能力中所起的作用非常巨大,这至少体现在以下4个方面:
1、新冠病毒与细胞膜直接“膜融合”的侵染效率,是其近亲病毒(如SARS)“内吞”方式的100~1000倍。
“内吞”感染的脱壳、复制比直接“膜融合”感染迟滞得多。以内吞方式进入进入细胞的SARS等病毒被隔离在内体(囊泡)中,它们要等待病毒包膜与内体膜或溶酶体膜发生融合,之后才向细胞开放环境中释放RNA以完成感染过程并开始病毒复制。
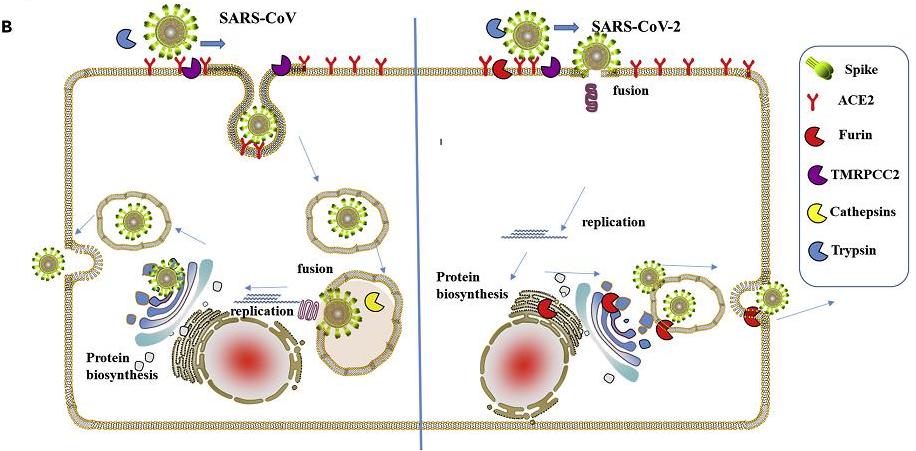
新冠与SARS细胞感染生命周期(侵入、脱壳、复制、扩散)对照图
2、可能赋予了新冠病毒不只一重杀死免疫细胞(淋巴细胞),破坏免疫系统的机制、途径;
3、直接膜融合的强悍侵染效率及furin蛋白酶的广泛存在性,极大地增强、加剧了新冠病毒的泛器官、泛组织感染、扩散、侵害能力。
4、可能还赋予了新冠病毒破坏、穿透血脑屏障,感染、损伤大脑、神经系统的能力。
S1/S2处的“PRRA”四个插入氨基酸(残基)没有一个是多余的。后三个氨基酸“RRA”与其后的R形成了furin酶切组合“RRAR”;第一个氨基酸-P(脯氨酸)也有特定的作用:脯氨酸P的存在很可能是为了调节融合前的构象,并降低融合的能量门槛,使新冠的病毒包膜与宿主细胞膜更容易发生膜融合。
关于脯氨酸在膜融合中的作用,可参考1998年12月英、法学者的如下论文(简记为论文-A):
A
Proline-Rich Motif Downstream of the Receptor Binding Domain Modulates
Conformation and Fusogenicity of Murine Retroviral Envelopes
受体结合域下游富含脯氨酸的基序调节鼠逆转录病毒包膜的构象和融合性
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC110509/
https://journals.asm.org/doi/10.1128/JVI.72.12.9955-9965.1998
也就是说,“PRRAR”比单纯的“RRAR”组合更有利于提升新冠病毒的感染效率。(这样的组合是随机、偶然出现的,还是精心设计的结果?)
事实上,单纯的“RRAR”已经是非常优异的furin酶切组合了。华中科技大学2020年10月的Cell-iScience论文(简记为论文-B):
Furin A Potential Therapeutic Target for COVID-19(Furin,COVID-19的潜在治疗靶点)
https://www.cell.com/iscience/fulltext/S2589-0042(20)30834-8
中的一项对比实验表明,“RARR”的水解、裂解效率是“RVRR”的2倍。“RVRR”是H7N1高致病性禽流感病毒一个土耳其毒株的furin酶切组合。
我多次强调过,新冠病毒是广为借鉴,集多种冠状病毒,多种非冠状病毒致病结构、致病能力于一身的跨科属病毒集大成者。从“PRRAR”这五个氨基酸上,我们对新冠病毒这一史无前例的特征可略窥一斑。
论文-A的研究、实验对象是鼠白血病病毒(MLV,Murine
Leukemia
Virus,一种逆转录病毒科,γ逆转录病毒属病毒;著名的艾滋病病毒HIV是逆转录病毒科慢病毒属病毒),“PRRAR”中的P-脯氨酸的使用可视为对鼠白血病病毒MLV结构特点的借鉴;
“RRAR”呢?它借鉴自毒性极强的小鼠肝炎病毒MHV-JHM株系、MHV-3株系,以及致死率极高的猫传染性腹膜炎病毒FIPV某些株系S1/S2处的“RRARR”酶切组合(这一复合furin
酶切组合包含两个基本 furin酶切组合“RRAR”和“RARR”)。
也就是说,仅S蛋白S1/S2处的“PRRAR”这五个氨基酸便存在两处借鉴迹象:
一是借鉴了几种特殊冠状病毒S1/S2处的“RRAR”furin酶切组合,使新冠病毒的S蛋白可被furin蛋白酶高效率地水解切割为分离的S1亚基、S2亚基。受体结合后S蛋白的水解切割是膜融合的先决条件;
二是借鉴了非冠状病毒--逆转录病毒MLV的相关结构特点,使用脯氨酸P来调节构象,降低膜融合的能量门槛,使病毒包膜与细胞膜更容易融合。
我们需要更明确地回答如下问题:新冠病毒S1/S2处的“RRAR”或“PRRAR”,是自然产生的,还是人为设计、引入的?
有很多病毒具有furin酶切位点,有不少冠状病毒在S1/S2处存在furin酶切位点,但是,
III、新冠病毒的近亲病毒都没有S1/S2处的furin酶切位点。具体而言:
1、与新冠同谱系、同支系(冠状病毒β谱系B支系)的新冠近亲病毒全都没有S1/S2处的furin酶切位点;
2、与新冠同谱系(冠状病毒β谱系)的蝙蝠冠状病毒全都没有S1/S2处的furin酶切位点;
3、S蛋白与新冠S蛋白相似度>40%的所有冠状病毒全都没有S1/S2处的furin酶切位点。
IV、新冠病毒S1/S2处的furin酶切位点不是自然演化产生的,它是人为设计、引入的;而且,新冠所使用的“RRAR”或者说“PRRAR”酶切组合是一个经过精心遴选、精心设计的性能非常优异的furin酶切组合。
由我的另一篇文章:
新冠furin酶切位点探源,病毒学界的集体捂瞒
可知,毒性(致病、致死能力)最强、对白变种实验室小鼠致死率接近100%的小鼠肝炎病毒MHV-JHM株系(Mouse
Hepatitis Virus John Howard Mueller
strain,亦称MHV-4),毒性次强的小鼠肝炎病毒MHV-3株系,以及一年内致死率几乎100%的猫传染性腹膜炎病毒FIPV(Feline
infectious peritonitis virus)的某些病毒株,这三种(类)病毒S蛋白S1/S2处都具有复合furin
酶切组合“RRARR”,其前四个氨基酸,恰恰就是新冠病毒的furin 酶切组合“RRAR”。
MHV-JHM、MHV-3都有很强的大脑和神经系统毒性(大脑和神经系统的感染、破坏能力),新冠病毒也有一定的大脑和神经系统毒性。这应该都与它们S1/S2处的“RRARR”或“RRAR”furin酶切位点有关。
新冠病毒为什么会和某些鼠肝炎病毒、猫传染性腹膜炎病毒具有相同的S1/S2处的“RRAR”furin酶切组合?
新冠病毒可能是这些病毒自然演化而来的吗?由“探源-捂瞒”一文第IV、V两部分可知,新冠病毒与它们亲缘关系极远,结构差异巨大,根本不存在进化可能;由文章第VI部分还可知,新冠的“RRAR”也几乎不可能是新冠的“近亲”病毒与MHV-JHM、MHV-3或FIPV自然重组获得的。
因此,新冠病毒S1/S2处的“RRAR”furin酶切位点不是自然演化(自然变异或自然重组)的结果,它是借鉴某些高毒性病毒的致病结构,人为设计、引入的。
小鼠是使用最广泛的实验室动物,小鼠肝炎病毒是人类研究最多的动物病毒;在小鼠肝炎病毒的20多个株系中,MHV-JHM和MHV-3不仅毒性最强,而且,它们与MHV-A59是最受关注、被研究最频繁的三大MHV株系。然而,对新冠病毒S1/S2处“RRAR”与MHV-JHM、MHV-3
S1/S2处“RRARR”之间显而易见的重大关联,病毒学界从未有人将之告知公众。
在(冠状)病毒中设计、引入furin酶切位点的研究、实验例证
在冠状病毒或其它病毒中设计、引入furin酶切位点,对科学家们来说,这不是一个高难度的病毒改造问题。不晚于1995年,已有人开始实施furin酶切位点的构建或改造研究,二十多年来,病毒学界做过许多相关研究、实验,包括以下几种情况:
1、在没有furin酶切位点的(冠状)病毒中插入一个或多个furin酶切位点;
2、在已有furin酶切位点的(冠状)病毒中插入新的furin酶切位点;
3、改造(冠状)病毒中既有furin酶切位点的furin酶切组合,对照研究不同酶切组合的水解、切割效率,促进病毒-细胞融合能力或促进细胞-细胞融合能力,以及与之相关的致病能力、致病效果等等;
自疫情发生至今,病毒学界从未有人向公众指出如下事实:“病毒学家们二十多年来做过许多的furin酶切位点插入研究、实验”。
病毒学界这一集体性的刻意回避、刻意捂瞒有力地配合了对“自然来源论”的鼓吹和对“实验室来源论”的大力污名、压制,使数十亿万世人至今不能意识到:新冠病毒S1/S2处的“RRAR”furin酶切组合完全有可能是人为设计、插入的。
新冠病毒必定源自从事冠状病毒功能增益改造的实验室,它不可能源自没有做过功能增益改造研究的武汉病毒研究所,这是溯源调查的第一个基本逻辑;
新冠疫情不是武汉病毒研究所泄漏造成的,长江南岸的武汉所实验室假设的泄漏不可能造成如下的实际疫情状况:新冠早期病例密集地集中于长江北岸以华南海鲜市场为中心的江汉区。这是溯源调查的第二个基本逻辑。
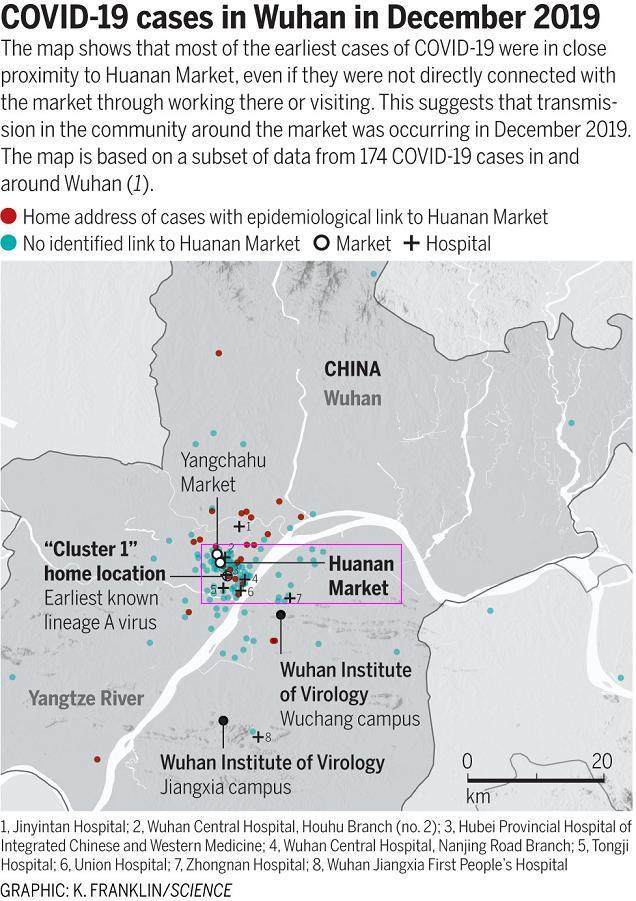
武汉新冠早期病例分布图
武汉病毒研究所没有泄漏新冠病毒,但新冠疫情却偏偏“选择”在武汉爆发,这一巧合的内在玄机非常值得我们深思。
捂盖集团(包括开展举国性质危险病原体功能增益改造研究的新冠病毒制造方集团,和新冠疫情制造方集团,这二大集团恰恰是秘密政治盟友。)至今仍在用“实验室泄漏论”阉割、篡改、偷换“实验室来源论”,用未做过功能增益改造研究,未泄漏新冠病毒的武汉本地实验室(主要是武汉病毒研究所)来转移视线,营造假相,隐匿新冠病毒的真正实验室来源,掩盖新冠大灾难产生的真正原因。
本文整理出了8篇“furin酶切位点插入”研究论文,3篇出自美国科学家,4篇分别出自荷兰、西班牙、日本、中国科学家,一篇是荷兰、瑞士、美国科学家的联合研究(以荷兰科学家为主);我开始准备的6篇论文都是2009年(含)前发表的,意识到它们有点偏“老”,我后来补充纳入了2014、2019年发表的论文各一篇。
我的愿望是,把每篇论文的要点细节(如研究了什么病毒,在病毒基因组的什么位置插入或构建了什么样的furin酶切组合,改造前后的实验现象、实验效果如何等)尽可能清楚地展现在大家面前,这不可避免地使本文的总体篇幅大大拉长。身为作者,写好每一篇文章,为您奉献清晰、准确、全面,没有重大遗漏的参考信息是我的责任和使命;而作为读者,您可以选择适当的阅读方式,不让篇幅成为您的阅读负担。您可对不同内容或精读或跳读,您可以只看论文标题、插图,对每篇论文会意即可,当然,如果您有兴趣和需要,您也可以深入了解、研究某一论文中的相关技术细节。即使您的阅读到这里为止,我相信,您的阅读、我的写作仍然是富有价值的。
8篇论文总体篇幅虽然很长,但反映的事实非常简单:在(冠状)病毒中构建furin酶切位点,不是什么稀罕事,而是时有发生的“寻常事”。
论文一
1995年12月20日,荷兰莱顿大学医学院微生物学院病毒学系的四位科学家在Elsevier-Virology上发表了如下论文:
Mutational Analysis of the Murine Coronavirus Spike Protein: Effect on Cell-to-Cell Fusion
鼠冠状病毒刺突蛋白的突变分析:对细胞间融合的影响
https://www.sciencedirect.com/science/article/pii/S0042682285700566
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7131709/pdf/main.pdf
https://coke.mml.unc.edu/highlight?paper=5feb92f2b38534fffa4575de8a13e46483fc1481&term1=CORONAPROT%23P0DTC2&term2=DRUG%23CHEMBL1536
这是一项改造冠状病毒中既有酶切位点的研究。
论文指出:
MHV-A59(S1/S2处)的切割信号为“RRAHR”,MHV-JHM(S1/S2处)的切割信号为“RRARR”,它们的切割信号只有一个氨基酸差异(H~R)。如果将A59切割信号中的组氨酸(H)替换为精氨酸(R),那么,得到的(切割信号与JHM相同的)A59变异体S蛋白的切割效果将显著提高(将有更高比例的S1、S2亚基被水解切割,裂解分离)。这表明,JHM切割信号中的倒数第二个精氨酸R对其S蛋白的切割效果非常重要。
上图是论文配图。图中的wt(wild-type)指未改造的MHV-A59。论文对“RRAHR”施以不同的氨基酸替换或删除,设计了7个A59人工变异体m1~m7。变体行中出现的字母(氨基酸缩写)表示用之替换对应位置原有的氨基酸,*表示删除对应位置原有的氨基酸);
7个变异体中,切割信号包含基本furin酶切组合,可被furin蛋白酶水解切割的变异体有3个:m3(GRAHR)、m5(RRAQR)、m7(RRARR)。这3个变异体最右边有+号表示可切割。
最下方的m7是用精氨酸(R)替换组氨酸(H)得到的,切割信号与JHM相同,S蛋白水解切割效果最佳的变异体。
作几点补充说明:
1、MHV-JHM的复合furin酶切组合“RRARR”倒数第二个精氨酸R之前的四个氨基酸“RRAR”就是新冠病毒S1/S2处的furin酶切组合。
2、MHV-A59的复合furin酶切组合“RRAHR”中只含一个基本furin酶切组合“RAHR”。将其中的H替换为R后,复合furin酶切组合变为“RRARR”。原有的“RAHR”变为“RARR”,同时,另外增加了一个基本furin酶切组合“RRAR”。这可能是水解切割效果显著提升的原因。
3、单独的精氨酸(R)是胰蛋白酶(trypsin)的切割位点。问题是,胰蛋白酶通常只存在于哺乳动物的小肠中,因此,单独的精氨酸发挥作用的场合极为有限。相比之下,furin蛋白酶则在脊椎动物的各种器官、组织中广泛存在,因此,furin酶切位点处处皆有用武之地。
4、小鼠肝炎病毒(MHV,Mouse
Hepatitis
Virus),属于冠状病毒β谱系的A支系(新冠病毒属于β谱系的B支系)。MHV病毒有超过25个株系,MHV-A59是其中毒性较强的一个株系,毒性最强的株系就是论文中的对照株系--MHV-JHM株系(即MHV-4)。
MHV-JHM有很强的大脑、神经毒性,其感染引发的强烈脑炎能使小鼠高比例瘫痪、死亡;
MHV-A59也有一定大脑、神经毒性,但比MHV-JHM要弱得多。这一差异的主要决定因素应该就是它们S1/S2处furin酶切组合的不同。
5、MHV-JHM S1/S2处的复合furin酶切组合“RRARR”包含新冠病毒S1/S2处的furin酶切组合“RRAR”。新冠病毒的大脑、神经系统感染、侵害能力很可能与“RRAR”有关。
论文二
2005年1月8日,北卡罗来纳州立大学分子与结构生物化学系教授Dennis T. Brown领导的一个四人研究小组在Elsevier-Virology期刊上发表了如下论文:
In
vivo processing and isolation of furin protease-sensitive alphavirus
glycoproteins: a new technique for producing mutations in virus assembly
弗林蛋白酶敏感的甲病毒糖蛋白的体内加工和分离:一种在病毒组装中产生突变的新技术
https://www.sciencedirect.com/science/article/pii/S0042682204008451
这是一项在非冠状病毒中引入furin酶切位点的研究,论文的研究、改造对象是辛德毕斯病毒。
辛德毕斯病毒(Sindbis
virus)是披膜病毒科(Togaviridae)甲病毒属(Alphavirus)的一种典型病毒,可感染啮齿动物、鸟类、家禽、家畜、人类等脊椎动物的神经元,诱发人类脑脊髓炎、脑膜炎、脑炎,并引发其它症状。辛德毕斯病毒的主要传播媒介是蚊子。
辛德毕斯病毒有三种结构蛋白:C蛋白(capsid
protein,核衣壳蛋白),两种包膜蛋白(envelope
protein)E1、E2。C蛋白包裹保护病毒RNA;E2蛋白负责受体识别,E1蛋白促成膜融合或(细胞)膜穿孔,以向靶细胞释放RNA;同时,E1、E2共同构成病毒包膜。成熟完整的辛德毕斯病毒三种结构蛋白皆为240
个拷贝。
Sindbis 病毒长啥样?看图:
甲病毒属病毒(Alphavirus)结构、外观示意图
https://viralzone.expasy.org/625
这个图和冠状病毒有点像。再看个图(样子有点恶心):
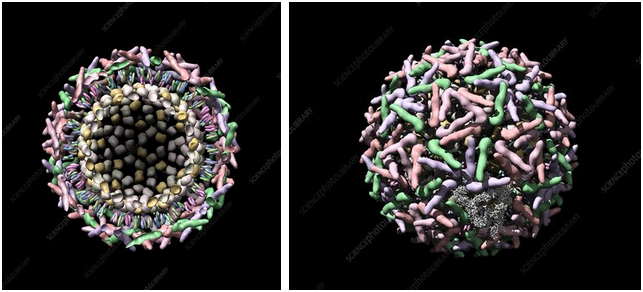
sindbis病毒透视和外观图
https://www.sciencephoto.com/media/249062/view/sindbis-virus-computer-model
回归论文。
该研究在辛德毕斯病毒E1蛋白(促成膜融合或膜穿孔以释放RNA的包膜蛋白)结构域编码区的五个不同位置(E1 aa 130、133、139、392、393)分别插入furin酶切位点,构建了五个辛德毕斯病毒的突变体(人工改造体)。
前三个插入位置(130、133、139)位于E1蛋白功能域、结构域边界附近,被设计用于切割E1蛋白功能域,它们对应的三个突变体统称为功能域突变体;
后二个插入位置(392、393)位于病毒包膜外表附近,被设计用于切割E1蛋白胞外域(E1蛋白在包膜外的突出部分),它们对应的突变体称为胞外域突变体。
aa即amino acid(氨基酸),E1 aa 130代表E1蛋白aa序列的第130个氨基酸。参见下图:
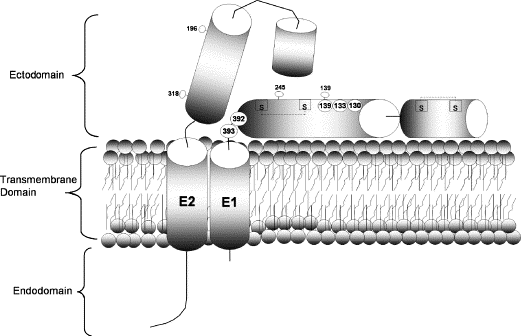
Sindbis 病毒 E1、E2 膜糖蛋白示意图及furin酶切位点插入位置
图中,
棒棒糖形状代表共同缔合、构成病毒包膜的E1、E2蛋白,各240个,每三对E1、E2构成一个E1、E2三聚体,病毒包膜由80个E1、E2三聚体缔合而成;
标有S 的空心方块代表对缔合病毒包膜、稳定其构象极为重要的二硫键。
标有数字的空心圆圈代表E1蛋白内工程化弗林蛋白酶切位点的插入位置,五个空心圆圈都在E1蛋白结构域内,130空心圆圈右边是预计将被切割掉的E1蛋白功能域,392、393圆圈大致位于E1蛋白结构域与E1蛋白胞外域的交界处。
五个位置引入的furin酶切位点的氨基酸组合包括两种模式:RXRR或RXLR。R代表精氨酸,L代表亮氨酸,X代表相应位置处某个既有的氨基酸。furin酶切位点的引入遵循“尽可能少改动既有氨基酸,尽可能利用序列中既有的氨基酸”的原则,在每一位点处,基于这一原则选择RXRR、RXLR
其中之一。
实验证明,在furin蛋白酶阳性(存在正常的furin蛋白酶)的BHK-21细胞(BHK细胞,Baby Hamster Syrian Kidney cell,叙利亚幼仓鼠肾细胞)培养液中:
1、在病毒复制过程中,在暴露的E1蛋白结构域中插入的furin酶切位点可导致部分E1蛋白功能域、胞外域在病毒组装前被furin蛋白酶水解切割掉;
2、被切割、截短的E1蛋白仍可被复制过程用于病毒包膜的组装,这使得复制过程组装出了结构不完整的病毒包膜;
3、包膜中不完整的E1蛋白可能不具备促成膜融合或膜穿孔的能力,由一定数量不完整E1蛋白组装出的病毒将失去感染能力。包含furin酶切位点的五个变异体复制产生感染性病毒的能力均大幅降低。相比未改造的野生型病毒,五个变异体在BHK-21
细胞培养液中感染性病毒的复制滴度都至少降低了三个数量级(野生型病毒复制滴度为6.50 ×
109pfu/ml,而五个变异体的复制滴度都小于6.00 × 106pfu/ml);
(这表明,furin酶切位点并非总是对病毒有利,过早发生的水解切割会破坏病毒的复制、组装。)

pfu:plaque forming unit,空斑形成单位;病毒形成的空斑数代表活性病毒粒子的相对数量;单位体积(ml)病毒形成的空斑数代表活性病毒粒子的相对浓度。
4、furin酶切位点引入位置恰好位于功能域、结构域交界处的130突变体的切割效率最高(129氨基酸是功能域的最后一个氨基酸,130氨基酸是结构域的第一个氨基酸),造成的感染性病毒的降低最显著(产生的非感染性病毒的数量也最多),它的感染性病毒复制滴度相比野生病毒降低了五个数量级。见Table
1。
5、另一组实验表明,在furin蛋白酶阴性(furin蛋白酶天生缺乏或被抑制)的CHO RPE.40
细胞(CHO细胞,Chinese hamster ovary
cell,源自中国仓鼠卵巢的上皮细胞系)培养液中,五个突变体的生长复制情况,,产生的感染性病毒的滴度情况都与野生型病毒大致相同,没有出现在BHK-21细胞中观察到的前述现象。仍见Table
1。
论文的通讯作者,北卡罗来纳州立大学分子与结构生物化学系教授Dennis T. Brown是Arbovax 公司的创始人之一,他曾就论文中的相关技术在各国申请了如下专利:
Insertion of furin protease cleavage sites in membrane proteins and uses thereof
在膜蛋白中插入弗林蛋白酶切割位点及其用途
https://patents.google.com/patent/AU2004238843B2/en
https://patents.google.com/patent/US7521209B2/en?inventor=Dennis+T.+Brown
https://patents.google.com/patent/CN1809643A/zh
论文三
2006 年3月7日,Montana大学生物科技中心的Jack Nunberg领导的一个三人小组在Elsevier-Virology期刊上发表了如下论文:
Furin cleavage of the SARS coronavirus spike glycoprotein enhances cell–cell fusion but does not affect virion entry
SARS病毒刺突(糖)蛋白的弗林切割增强了细胞-细胞融合,但不影响病毒进入
https://www.sciencedirect.com/science/article/pii/S0042682206000900
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7111780/
该研究对SARS病毒(SARS-CoV)Spike蛋白(S蛋白,刺突蛋白)S1/S2位点附近的氨基酸序列进行了有关改造,构建了三个带有furin酶切位点的S蛋白人工变异体,见下图。

SARS-CoV(wild-type)及其三个人工变异体在S1/S2附近的氨基酸序列对照图
最上方(wild-type)一行是未改造的SARS病毒S蛋白氨基酸序列。
标有数字667的黑色菱形方块指示的R667(S蛋白的第667氨基酸R,R代表精氨酸)是SARS S蛋白S1亚基的最后一个氨基酸(残基);
另一个黑色菱形方块指示的K672(S蛋白的第672氨基酸K,K代表赖氨酸)是改造区域的右边界,它是S2亚基的第5个氨基酸。
三个S蛋白变异体分别命名为HTR、HTVR、SLLR。
HTR是将HT与R之间的五个氨基酸VSLLR替换为RRSRR得到的;
HTVR是将HTV与R之间的四个氨基酸SLLR替换为RRSRR得到的;
SLLR是将SLLR之后的STSQK替换为RSRR得到的。
在三个变异体中都构建出了复合furin酶切组合“RRSRR”(在上图中用下划线标出),它包含两个基本furin酶切组合“RRSR”和“RSRR”;
“RRSRR”在三个变异体中的起始、终止位置不同,因而它们的furin蛋白酶水解切割位点有所不同(furin蛋白酶的切割位置是RXXR的最后一个R)。HTR的切割位点应是R666和R667,HTVR的切割位点是R667(S1亚基的最后一个氨基酸)和R668(S2亚基的第一个氨基酸),SLLR的切割位点则应是R670和R671。
注:RRSRR借鉴自一种牛冠状病Mebus毒株S1/S2处的furin酶切组合,牛冠状病毒属于β谱系A支系,SARS和新冠病毒属于β谱系B支系。
主要实验结论如下:
1、S1/S2处的R667(S1亚基的最后一个氨基酸)是S蛋白的一个重要氨基酸,将它替换为丝氨酸S将使S蛋白促进细胞-细胞融合的能力下降40%,预测R667可能是一个易受蛋白酶水解裂解影响的位点;
2、HTVR的水解裂解效果最显著,HTR的水解裂解不如HTVR那么明显,SLLR的水解裂解非常微弱;
3、在表达HTVR-S蛋白的COS-7细胞培养物,和表达HTR-S蛋白的COS-7细胞培养物中,很容易分离到水解切割脱落下来的S1亚基,表达SLLR-S蛋白的COS-7细胞培养物中也能分离出少量脱落的S1亚基,而表达wild-type
SARS S蛋白(未经改造)的COS-7细胞培养物中则不能分离出独立存在的S1亚基;
注:COS-7细胞是含有SV40病毒基因组的非洲绿猴肾成纤维细胞,SV40病毒即猿猴空泡病毒40。表达S蛋白的COS-7细胞是将S蛋白基因添加入(转染)COS-7细胞DNA得到的。
4、三种变异体S蛋白的(ACE2)受体结合能力与野生型S蛋白不存在明显差异;
5、在表达S蛋白(野生型或变异体S蛋白)的COS-7细胞与表达人类ACE2的COS-7细胞的混合培养物中,HTVR-S蛋白和HTR-S蛋白表现出更强的促进细胞-细胞融合,形成合胞体的能力(合胞体是细胞-细胞融合产生的多核扩大细胞)。HTVR-S蛋白诱发产生的合胞体数量比野生型S蛋白多3到8倍;HTR-S蛋白诱发产生的合胞体数量是野生型S蛋白的1.8倍;相比之下,SLLR-S蛋白的促进融合能力反而比野生型S蛋白要弱;
6、用HTVR-S蛋白、野生型S蛋白分别与去毒性HIV-1病毒嵌合制成假病毒,用两种假病毒感染293T细胞(插入SV40病毒
T-抗原基因的人胚肾细胞株293 ),未发现它们感染能力的明显差异,携带HTVR-S蛋白的假病毒感染能力仅仅略强于携带野生型S蛋白的假病毒。
对第6点作一些补充说明。该论文未发现HTVR变异体假病毒感染能力的明显提升,可能有两个原因。
第一个可能的原因是,假病毒实验有时是失真的,不能真实反映被模拟病毒的实际感染能力;
第二个可能的原因是,HTVR-S蛋白的水解切割可能发生得过早(比如可能有大量S1亚基尚未完成受体结合就被切割掉了)。
荷兰乌得勒支大学(Utrecht University)2008年6月的一篇Journal of Virology 论文对第二个可能原因专门作出过说明:
Cathepsin
L Functionally Cleaves the Severe Acute Respiratory Syndrome
Coronavirus Class I Fusion Protein Upstream of Rather than Adjacent to
the Fusion Peptide
组织蛋白酶 L 对SARS病毒的功能性切割(发生在)I 类融合蛋白上游而不是与融合肽相邻(的部位)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2519682/
https://journals.asm.org/doi/10.1128/JVI.00415-08
论文尾部对某些研究未能提升病毒感染能力给出的解释是:
...Such
a scenario might explain the results of earlier attempts to enhance
(pseudo)virion infectivity by exogenous spike cleavage or by engineering
a furin cleavage site in the S protein, which may have failed due to
premature loss of S1 (8, 12).
。。。这种情况可以解释早期尝试通过外源刺突切割(添加外源性胰蛋白酶从R667处对S蛋白水解切割)或通过在 S 蛋白中设计furin切割位点来增强(伪)病毒粒子感染性,这(些尝试)可能由于 S1(亚基)的过早丢失而失败 (8, 12)。
上述解释内容针对两篇相关论文 (8, 12),其中的论文8,就是本文当前正在介绍的论文三。
论文四
2008年4月2日,西班牙卡洛斯三世健康研究所国家微生物学和CIBER 呼吸系统疾病中心的José A. Melero等三位科学家在Journal of Virology(病毒学杂志)在线发表了如下论文:
Insertion
of the Two Cleavage Sites of the Respiratory Syncytial Virus Fusion
Protein in Sendai Virus Fusion Protein Leads to Enhanced Cell-Cell
Fusion and a Decreased Dependency on the HN Attachment Protein for
Activity
在仙台病毒融合蛋白中插入呼吸道合胞病毒融合蛋白的两个(furin)切割位点可增强细胞-细胞融合并降低对 HN 附着蛋白活性的依赖性
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2395136/
https://journals.asm.org/doi/full/10.1128/JVI.00078-08
论文的研究对象是两种病毒:仙台病毒和(人或牛)呼吸道合胞病毒。这两种病毒同属副黏液病毒科(Paramyxoviridae,也称为副黏病毒科)但分属不同亚科,仙台病毒(Sendai
Virus,缩写为SeV)属于副黏液病毒亚科(Paramyxivirinae),人呼吸道合胞病毒(Respiratory Syncytial
Virus,RSV)属于肺炎病毒亚科(Pneumovirinae)。
仙台病毒(SeV)也称为鼠呼吸道病毒(Murine
Respirovirus)、鼠副流感病毒1型或日本血凝病毒 (HVJ,Hemagglutinating virus of
Japan),它通常感染啮齿动物;它也有人类、家畜感染能力但没有致病性(有人类、家畜细胞进入能力,但不会造成临床疾病症状)。
呼吸道合胞病毒(RSV)的致病能力比仙台病毒(SeV)强得多,它能引发人类、家畜不同程度的肺部、呼吸道感染及其它症状。
人呼吸道合胞病毒在成人和大龄儿童中通常引起感冒样症状;它有时可引发感染性肺炎、细支气管炎、入肺小气道通道发炎;它还可能导致早产儿、患有慢性心脏或肺部疾病的婴儿和成人、及免疫能力低下者发生重度感染甚至危及生命。
有一种牛呼吸道合胞病毒致病能力更强,它能使成年牛死亡或流产。
仙台病毒(SeV)、呼吸道合胞病毒(RSV),这俩病毒长啥样呢?
电子显微镜下的仙台病毒外观
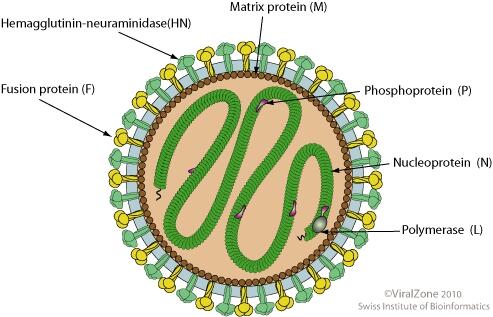
仙台病毒结构示意图
电子显微镜下的呼吸道合胞病毒(RSV)
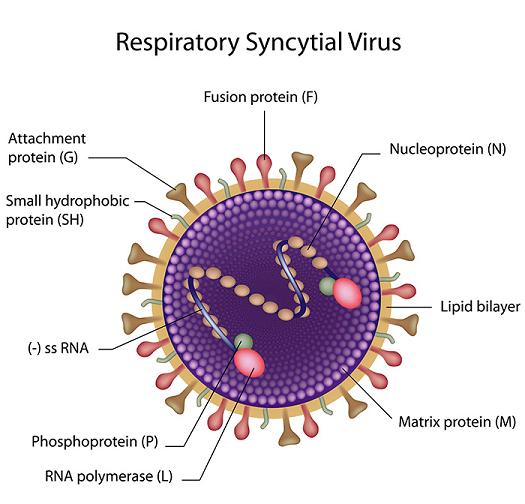
呼吸道合胞病毒结构示意图
副粘病毒进入细胞需要病毒包膜与靶细胞膜融合(与新冠的感染方式类似),融合是由病毒F糖蛋白(fusion蛋白,融合蛋白)介导的,通常还需要某个(负责受体结合的)附着糖蛋白(G、H
或
HN,取决于具体病毒)的共同参与。比如,仙台病毒(SeV)病毒包膜与细胞膜的融合过程必须绝对依赖其附着蛋白--HN蛋白(Hemagglutinin-neuraminidase
,血凝素-神经胺酸酶)与F蛋白的共同参与(并且还需要细胞环境中存在胰蛋白酶);呼吸道合胞病毒(FSV)是副粘病毒中一个独有的特例,它的F蛋白可以不依赖其附着蛋白—G蛋白独立介导病毒包膜与靶细胞膜的膜融合(SeV的附着蛋白是HN蛋白,而FSV的附着蛋白是G蛋白)
。
呼吸道合胞病毒(FSV)的独特能力源自它F蛋白的独特结构:它的F蛋白有两个furin酶切位点。而大多数副粘病毒的F蛋白则没有furin酶切位点,包括仙台病毒(SeV),它的F蛋白只有一个单碱基酶切位点(精氨酸R116,胰蛋白酶切位点)。
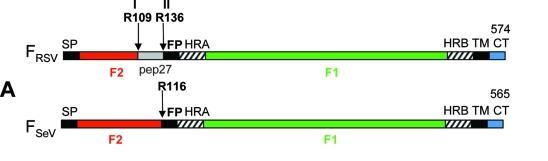
RSV、SeV F蛋白结构对照图
如上图所示,F_RSV(RSV的F蛋白)在R109(F蛋白的第109氨基酸,精氨基酸R)处和R136处各有一个furin酶切位点;F_SeV(RSV的F蛋白)没有furin酶切位点,它在R116处有一个单碱基胰蛋白酶切位点(单一精氨酸R116)。
F_RSV R109处、R136处的furin酶切组合分别为RARR、RKRR,见下图:

F_RSV R109、R136处的两个furin酶切位点
为研究F_RSV的两个furin酶切位点在病毒感染和膜融合中的作用,论文参照F_RSV结构,构建了6个F_SeV(SeV的F蛋白)的变异体,其中两个变异体中各包含一个furin酶切位点,另外四个各包含两个furin酶切位点,见下图:
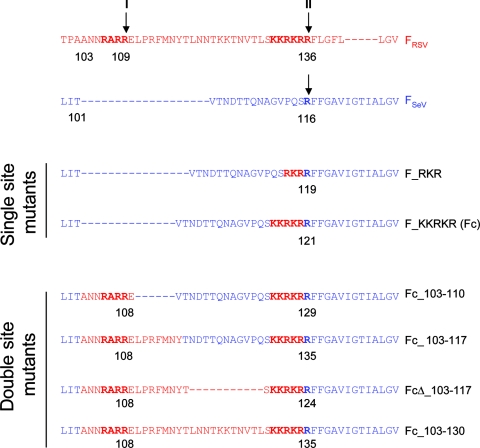
F_SeV的六个furin酶切位点变异体
如上图,两个F_SeV的单furin酶切位点突变体分别插入了F_RSV R109、R136处的furin酶切组合;
四个F_SeV的双furin酶切位点突变体同时插入了F_RSV R109、R136处的furin酶切组合,但它们第二个furin酶切组合的具体插入位置不同,两个furin酶切组合之间的氨基酸序列也不相同;
图中所有蓝色氨基酸都来自F_SeV,所有红色氨基酸都来自F_RSV;
双位点突变体名称中的Fc代表fusion (protein)cleavage(mutants),“Δ”表示突变体删除了FSeV中原有的若干氨基酸;
双位点突变体第二个位点的插入都是KKRKR;它们在第一个位点插入了不同长度的F_RSV氨基酸序列片断,比如,Fc_103-110插入了序号介于第103-110之间的8个F_RSV氨基酸“ANNRARRE”。
最后一个突变体Fc_103-130包含完整的F_RSV的pep27序列,pep27序列指F_RSV的两个切割位点之间的27个氨基酸(残基)(E110~R136)。RSV需要furin蛋白酶水解切割掉两个furin酶切位点之间的pep27区域以激活F蛋白的病毒-细胞膜融合能力及细胞-细胞膜融合能力。
实验证明:
1、只有当SeV的附着蛋白HN和外源性胰蛋白酶同时存在时,F_SeV才能促成细胞-细胞融合形成合胞体;
当不存在(RSV的)附着蛋白G,且没有胰蛋白酶时,F_RSV 仍然能有效促成细胞-细胞融合形成合胞体;不过,附着蛋白G和胰蛋白酶的存在能更显著地增进FRSV 的细胞-细胞融合能力并形成更大的合胞体。见下图:
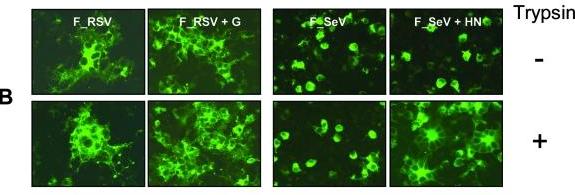
F_RSV、F_SeV细胞-细胞融合能力对附着蛋白和Trysin的依赖情况
2、两个F_SeV单furin酶切位点突变体的细胞-细胞融合能力仍然依赖附着蛋白HN的存在。其中,F_RKR的细胞-细胞融合能力还同时依赖胰蛋白酶,而F_KKRKR(Fc)的细胞-细胞融合能力则不必依赖胰蛋白酶。见下图:
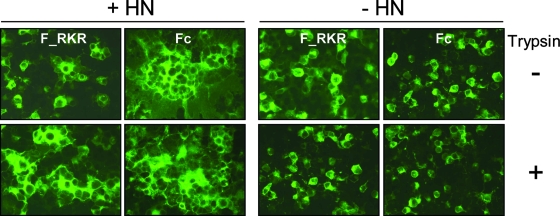
F_SeV单furin酶切位点突变体细胞-细胞融合能力对HN和Trysin的依赖情况
如上图所示,在没有HN蛋白存在时,无论细胞环境中有无胰蛋白酶,两种单furin变异体都不能显著促成细胞-细胞融合(右侧四图);在有HN蛋白共同存在时,F_RKR的细胞-细胞融合能力仍然依赖于胰蛋白酶的同时存在(第一列两图),而F_KKRKR(Fc)即使在没有胰蛋白酶存在时,也能促成产生很大的多核合胞体(图中的黑点对应细胞核),它的这一能力会因胰蛋白酶的存在而进一步加强(第二列两图)。
3、所有F_SeV双furin酶切位点突变体都具有非常强的细胞-细胞融合能力。
3-A) 当有HN蛋白共同存在时,所有F_SeV双furin突变体的细胞-细胞融合能力均不依赖于胰蛋白酶,不论有无胰蛋白酶存在,它们都能形成了极大的合胞体,见下图:
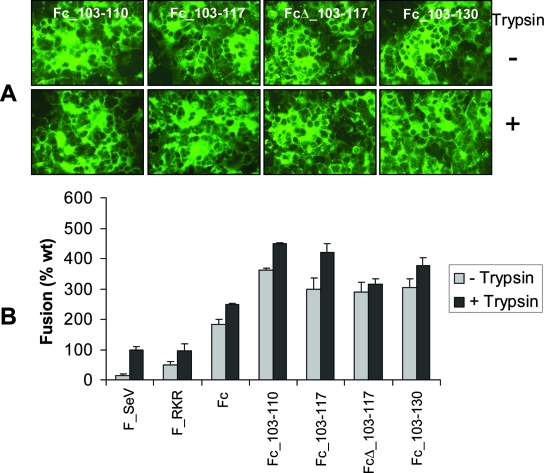
HN蛋白存在时的细胞-细胞融合实验结果
图A是四种双furin突变体的细胞-细胞融合促成情况;图B是未改造的F_SeV(wt:wild
type)及六种突变体的细胞-细胞融合能力对比情况,以F_SeV(wt)在有HN和Trypsin存在时的融合能力为100%
对照基准。A、B两图的实验均有HN蛋白存在;
3-B)F_SeV双furin酶切位点突变体对HN蛋白的依赖显著降低,即使HN蛋白及胰蛋白酶都不存在时,双furin突变体也具有不同程度的的细胞-细胞融合能力,除FcΔ_13-117外,其它三种双furin突变体都能形成很大的合胞体,见下图:
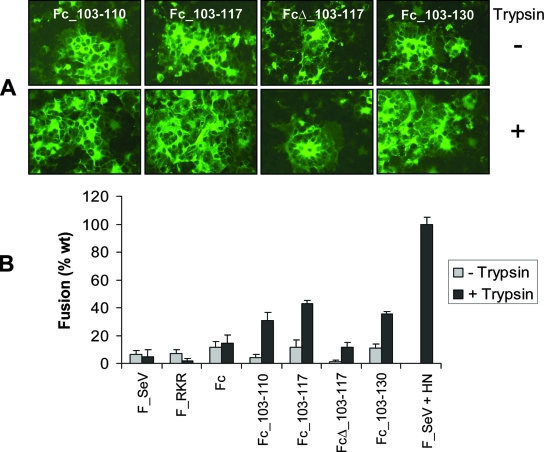
HN蛋白不存在时的细胞-细胞融合实验结果
限于篇幅,余下四篇论文将另文贴出。
(未完待续)
|
